
 2NH3
2NH3 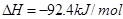 ,有关该反应的叙述正确的是( )
,有关该反应的叙述正确的是( )| A.正催化剂能加快正反应速率v正,不影响v逆,所以缩短了反应达平衡所需的时间 |
B.将lmol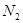 和3mol 和3mol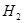 充分反应达到平衡时,放出的热量等于92.4kJ 充分反应达到平衡时,放出的热量等于92.4kJ |
| C.当c(N2):c(H2):c(NH3)=1:3:2时,反应就达到平衡状态 |
| D.平衡时增大氮气的浓度,达新平衡时N2 转换率减小,H2转化率增大 |
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源:不详 题型:填空题
 cC(s)+dD,当反应进行一定时间
cC(s)+dD,当反应进行一定时间 后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白:
后,测得A减少了nmol,B减少了1/2 n mol,C增加了3/2 n mol,D增加了n mol,此时达到化学平衡。请填写下列空白: 反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。
反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为________反应(填“放热”或“吸热”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O3+O2,②N2O3
N2O3+O2,②N2O3 N2O+O2;在1 L密闭容器中充入4 mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L。则t℃时N2O的平衡浓度为
N2O+O2;在1 L密闭容器中充入4 mol N2O5,加热到t℃,达到平衡状态后O2的平衡浓度为4.5 mol/L,N2O3的平衡浓度为1.7 mol/L。则t℃时N2O的平衡浓度为| A.0.1 mol/L | B.1.4 mol/L | C.2.38 mol/L | D.2.88 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
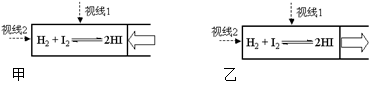
| A.从甲中的视线1观察到颜色变浅 |
| B.从乙中的视线1观察到颜色变深 |
| C.从乙中的视线2观察到颜色不会变化 |
| D.探究压强对化学平衡的影响时,应从视线2观察 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 CH3OH(g)。
CH3OH(g)。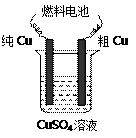
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
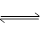 2C(g);△H > 0 。下列反应有利于生成C的是:
2C(g);△H > 0 。下列反应有利于生成C的是:| A.低温、低压 | B.低温、高压 | C.高温、高压 | D.高温、低压 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,H2(g)+CO2(g)
,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=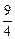 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示:| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/ mol·L—1 | 0.010 | 0.02 0 0 | 0.020 |
| c(CO2)/ mol·L—1 | 0.010 | 0.010 | 0.020 |
| A.平衡时,乙中CO2的转化率大于60% |
| B.平衡时,甲和丙中H2的转化率均是60% |
| C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L—1 |
| D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)  N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: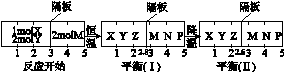
 2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com