
【题目】某小组利用含铅废料(主要含PbO、PbSO4和PbO2)制备化工产品(PbSO4·3PbO·H2O)的工艺流程如图:

已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题:
(1)“转化”时,加入Na2CO3的目的是将PbSO4转化成PbCO3,其转化原理是___________。PbO2转化为PbCO3的离子方程式为_________。
(2)该流程中可以循环利用的物质是_________,若其中残留过多SO42-,循环利用可能出现的问题是__________。
(3)一定浓度的硝酸溶解PbCO3和PbO时,“酸溶”时,金属离子浸出率与温度的关系如图所示。当温度为40℃,金属离子浸出率最高,其主要原因是________。

(4)取一定量的含铅废料经上述“转化”,假设含铅废料中的PbO2和PbSO4全部转化成PbCO3,且PbO未发生反应,“酸溶”时共收集到5.6 L CO2(标准状况),“沉铅”时得到121.2 g PbSO4。
①原含铅废料中含PbO的物质的量为__________。
②“合成”时,加入NaOH的质量为__________。
(5)工业上,电解Pb(NO3)2溶液制备活性电极材料PbO2,其阳极的电极反应式为_________。
【答案】溶解度较大的物质容易转化成溶解度较小的物质 PbO2+H2O+SO32-+CO32-=PbCO3+SO42-+2OH- HNO3 PbSO4覆盖在PbCO3表面阻止反应 温度低于40℃时反应速率慢;温度高于40℃时硝酸挥发和分解速率加快 0.15mol 24g Pb2++2H2O-2e-=PbO2+4H+
【解析】
含铅废料的主要成分为PbO、PbSO4和PbO2,加入Na2SO3后产物为PbO、PbCO3,PbO2中铅元素化合价降低,说明发生氧化还原反应;加入稀硝酸溶解难溶的PbO、PbCO3,再加稀硫酸生成硫酸铅,最后加入氢氧化钠溶液得到产物。由已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13可知,PbSO4溶解度大于PbCO3。
(1)由溶度积可知,PbSO4的溶解度大于PbCO3,所以加入碳酸钠将PbSO4转化为PbCO3。加入Na2SO3后PbO2中铅元素化合价降低,Na2SO3还原PbO2,S元素化合价升高,根据电子守恒,得到离子方程式PbO2+H2O+SO32-+CO32-=PbCO3+SO42-+2OH-。
(2)“沉铅”时,发生反应Pb(NO3)2+H2SO4=PbSO4+2HNO3,硝酸在“酸溶”过程中做为反应物,故可循环利用的物质为HNO3。稀硝酸中残留过多SO42-,会生成难溶的硫酸铅,PbSO4覆盖在PbCO3表面,阻止碳酸铅与稀硝酸反应。
(3)由图象可知,当温度低于40℃时反应速率慢,金属离子浸出率低;温度高于40℃时硝酸挥发和分解速率加快,导致反应物浓度降低,反应减慢,金属离子浸出率降低。
(4)①“沉铅”时得到121.2 g PbSO4,n(PbSO4)=![]() ,“酸溶”时共收集到5.6 L CO2(标准状况),n(CO2)=0.25mol。“转化”过程中PbSO4和PbO2转化为PbCO3,酸溶”时PbCO3与稀硝酸反应生成CO2,故原料中PbSO4和PbO2共0.25mol,而PbO、PbSO4和PbO2的总物质的量为0.4mol,故原含铅废料中含PbO的物质的量为0.15mol。
,“酸溶”时共收集到5.6 L CO2(标准状况),n(CO2)=0.25mol。“转化”过程中PbSO4和PbO2转化为PbCO3,酸溶”时PbCO3与稀硝酸反应生成CO2,故原料中PbSO4和PbO2共0.25mol,而PbO、PbSO4和PbO2的总物质的量为0.4mol,故原含铅废料中含PbO的物质的量为0.15mol。
②加入氢氧化钠溶液发生反应PbSO4+2NaOH=PbO+Na2SO4+H2O,由产品组成PbSO4·3PbO·H2O可知,0.4molPbSO4中有0.3mol转化为0.3mol PbO,根据化学方程式可知,加入NaOH的物质的量为0.6mol,质量为0.6mol×40gmol-1=24g。
(5)阳极上发生氧化反应,水提供氧元素生成的PbO2和HNO3,故阳极的电极反应式为Pb2++2H2O-2e-=PbO2+4H+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了探究KI与FeCl3的反应为可逆反应,且有一定的限度,某化学小组进行了两组实验:
(1)请写出KI溶液与FeCl3溶液反应的离子反应方程式:______;
实验I:探究KI与FeCl3的反应为可逆反应
步骤1:设计如下图原电池装置,接通灵敏电流计,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
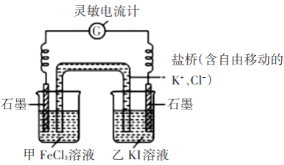
步骤2:当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体;
(2)若灵敏电流计出现_________(答现象),则证明该反应为可逆反应。实验结论:该反应为可逆反应。
(3)根据以上实验结论解释步骤1中“最后读数变为零”的原因_______;
(4)加入FeCl2和碘固体后,正极的电极反应式为______;
实验II:证明KI与FeCl3的反应有一定限度。
步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡;
步骤4:取少量反应后的溶液,向其中加入几滴淀粉溶液,充分振荡;
(5)观察到的现象是________;
步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,则证明该反应有一定限度。
(6)但有同学认为步骤5现象不能证明得出的结论,原因是______,修正实验方案后得到结论:该反应有一定的限度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将无机碳转化为有机化合物是目前研究的热点,也是减少CO2和CO的有效措施之一,对环境的保护起到了积极作用。
I.二氧化碳催化加氢甲烷化工艺是利用氨还原CO2,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(l)H1。
CH4(g)+2H2O(l)H1。
(1)已知:H2(g)的燃烧热H2=-285.8kJ·mol-1,CH4(g)的燃烧热H=-890.3kJ·mol-1,则△H1=________kJ·mol-1。
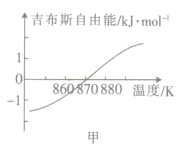
(2)测得该反应的吉布斯自由能(G=H-TS)随温度的变化曲线如图甲所示,为使CO2顺利转化为CH4,反应应在___下进行。
II.一氧化碳催化加氢制甲醇:CO(g)+2H2(g)![]() CH2OH(g)。
CH2OH(g)。
(3)图乙是反应中部分物质的浓度随时间t的变化情况,0~10min内,用H2表示的平均反应速率v(H2)=_____,该反应平衡常数的表达式为_______________。
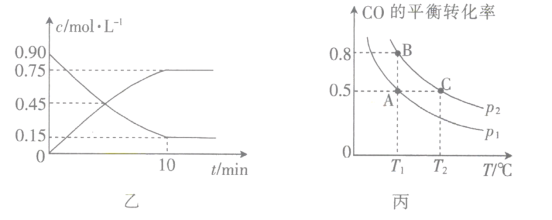
(4)在容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图丙所示。
①p1______(填“>”“<”或“=”)p2。
②比较图丙中A、C两点,平衡常数KA__________(填“>”“<”或“=")KC。
③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数KA=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大环多醚称为冠醚。二苯并-18-冠-6的结构简式如图所示。下列说法不正确的是
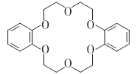
A.该有机物的分子式为C20H24O6
B.该有机物中所有原子不可能共平面
C.在光照下,该有机物与氯气反应的一氯代物有4种(不考虑立体异构)
D.1 mol该有机物的苯环最多可与6 mol H2发生加成反应(不考虑开环加成)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图一致的是:

A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) ![]() CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
D.图④ 中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成有机光电材料的原料。H的一种合成路线如图:
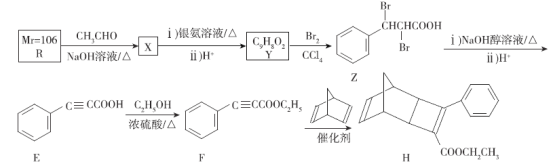
已知:R属于芳香族化合物,与新制Cu(OH)2悬浊液共热产生红色固体。请回答下列问题:
(1)R的化学名称是___________;X中官能团的名称是___________。
(2)F→H的反应类型是___________。
(3)E→F的化学方程式为______________。
(4)检验Z中溴元素的试剂有NaOH溶液、AgNO3溶液和___________。
(5)在Y的同分异构体中,同时具备下列条件的同分异构体有________种(不包含立体异构)。
①能发生银镜反应;②遇氯化铁溶液发生显色反应;③能与溴的四氯化碳溶液发生加成反应。
其中核磁共振氢谱有6组峰且峰面积比为1:1:1:1:2:2的结构简式为_________。
(6)参照上述流程,请设计以一溴环已烷和2-丁炔为起始原料制备![]() 的合成路线:__________(无机试剂任选)。
的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备纯碱的原理为:NaCl+CO2+NH3+H2O→NH4Cl+NaHCO3↓。完成下列填空:
(1)上述反应体系中出现的几种短周期元素,非金属性最强的是__,第二周期原子半径由大到小的是__。
(2)反应体系中出现的非金属元素可形成多种化合物,其中和铵根离子空间构型相同且属于有机物的电子式是__,该分子为__(选填“极性”、“非极性”)分子。
(3)写出上述元素中有三个未成对电子的原子核外电子排布式__,下列关于该元素和氧元素之间非金属性大小判断依据正确的是___(填编号)
a.最高价氧化物对应水化物的酸性
b.两元素形成化合物的化合价
c.气态氢化物的稳定性
d.氢化物水溶液的酸碱性
侯氏制碱法也称联碱法,联合了合成氨工厂,发生如下反应:N2+3H2![]() 2NH3
2NH3
(4)工业为了提高H2的转化率,一般会加入稍过量的N2,这样做对平衡常数的影响是__(填“变大”,“变小”或“无影响”,下同),对N2的转化率的影响是___,对H2的反应速率的影响是__。
(5)该反应的催化剂是__(填名称)。反应本身为放热反应,但是工业仍然选择高温的理由是:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸钾熔化,粒子间克服了__的作用力;二氧化硅熔化,粒子间克服了__的作用力;碘的升华,粒子间克服了__的作用力.三种晶体的熔点由高到低的顺序是__.
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为__(填序号).
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有__,由非极性键形成的非极性分子有__,能形成分子晶体的物质是__,含有氢键的晶体的化学式是__,属于离子晶体的是__,属于原子晶体的是__,五种物质的熔点由高到低的顺序是__.
(4)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:A.__;B.__;C.__;D.__.
(5)图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.__;B.__;C.__;D.__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是

A. 维生素C中含有3种官能团
B. 维生素C分子式为C6H8O6
C. 维生素C能使酸性高锰酸钾溶液褪色
D. 维生素C在碱性溶液中能稳定存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com