
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:


(1)几种盐的溶解度见图1。反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行________、________、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是:_____________________________________。
(3)反应Ⅳ的化学方程式为______________________________________________。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为____________________________________________。
(5)图2是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为___________________。
②煅烧过程中固体的锰含量随温度的升高而增大,但当温度超过1000 ℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因:____________________________。
(6)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂Mn3O4的二氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向________(填“正”或“负”)极移动。电池负极电极反应为________________________。
【答案】 蒸发结晶 趁热过滤 取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,若有白色沉淀产生,则有氯化物杂质;若没有明显现象,则没有氯化物杂质 MnO2+SO2=MnSO4 Mn3O4+8H++2Cl-![]() 3Mn2++Cl2↑+4H2O Mn3O4 部分Mn3O4又被氧化为Mn2O3或MnO2,造成总锰含量减小 负 C4H10-26e-+13O2-=4CO2+5H2O
3Mn2++Cl2↑+4H2O Mn3O4 部分Mn3O4又被氧化为Mn2O3或MnO2,造成总锰含量减小 负 C4H10-26e-+13O2-=4CO2+5H2O
【解析】(1)四种物质中相同温度下硫酸钾溶解度最小,所以反应Ⅲ中蒸发浓缩后硫酸钾析出,趁热过滤减少杂质,得硫酸钾晶体,再洗涤、干燥即可,故答案为:蒸发结晶;趁热过滤;
(2)检验Cl-用硝酸银溶液和稀硝酸,同时又要除去干扰实验的硫酸根离子,具体方案为:取少量溶液于试管中配成溶液,滴加过量的Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,若有白色沉淀产生,则有氯化物杂质;若没有明显现象,则没有氯化物杂质,故答案为:取少量溶液于试管中配成溶液,滴加过量的Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,若有白色沉淀产生,则有氯化物杂质;若没有明显现象,则没有氯化物杂质;
(3)二氧化硫与二氧化锰反应,除杂后得到硫酸锰晶体,可知二者反应生成硫酸锰,反应方程式为:MnO2+SO2=MnSO4,故答案为:MnO2+SO2=MnSO4;
(4)+4价锰离子具有氧化性可以氧化氯离子为氯气,四氧化三锰可改写为MnO22MnO,MnO2与浓盐酸生成MnCl2、Cl2和H2O、MnO与盐酸生成MnCl2和H2O,反应方程式为:Mn3O4+8H++2Cl-![]() 3Mn2++Cl2↑+4H2O,故答案为:Mn3O4+8H++2Cl-
3Mn2++Cl2↑+4H2O,故答案为:Mn3O4+8H++2Cl-![]() 3Mn2++Cl2↑+4H2O;
3Mn2++Cl2↑+4H2O;
(5)①热重曲线中一般先失去结晶水(可能分步),100gMnSO4H2O中结晶水的质量为100g×![]() =10.65g,可知A为硫酸锰,升高温度盐分解得到金属氧化物,由流程图可知硫酸锰晶体锻烧得到四氧化三锰,100gMnSO4H2O分解可以得到四氧化三锰的质量为
=10.65g,可知A为硫酸锰,升高温度盐分解得到金属氧化物,由流程图可知硫酸锰晶体锻烧得到四氧化三锰,100gMnSO4H2O分解可以得到四氧化三锰的质量为![]() ×
×![]() ×229g/mol=45.17g,故B为Mn3O4,故答案为:Mn3O4;
×229g/mol=45.17g,故B为Mn3O4,故答案为:Mn3O4;
②继续加热产物中总锰含量反而减小,说明吸收了氧,进一步说明B中的锰元素存在低价,可能是部分Mn3O4又被氧化成Mn2O3或MnO2,造成总锰含量减少,故答案为:部分Mn3O4又被氧化成Mn2O3或MnO2,造成总锰含量减少;
(6)原电池中阴离子向负极移动,阳离子向正极移动,通入丁烷一极是负极,由于电解质为非水物质,则电解质中不存在OH-离子,正确的电极反应式为C4H10+13O2--26e-=4CO2+5H2O;通入空气的一极为原电池的正极,发生还原反应,电极反应式为O2+4e-=2O2-,故答案为:负;C4H10-26e-+13O2-=4CO2+5H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某处温泉有“圣水”之美誉,经常洗浴对治疗各种皮肤病、神经衰弱等有特殊的功效。经专家鉴定泉水中含有人体生命活动所需的微量元素,它们可能是
A.Fe、Mn、Zn、MgB.Zn、Cu、Mn、Ca
C.Zn、Cu、B、MnD.Mg、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.
在0~60s时段,反应速率v(N2O4)为 molL﹣1s﹣1
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0molL﹣1s﹣1的平均速率降低,经10s又达到平衡.T100℃(填“大于”或“小于”),判断理由是 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向(填“正反应”或“逆反应”)方向移动,判断理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素中:A是地壳中含量最高的元素;B比Ne的质子数多1个;C最外层电子数与其电子层数相等;D单质是半导体材料;E非金属性在同周期元素中最强。下列说法中正确的是
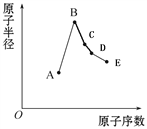
A. B离子的半径比C离子的半径小
B. C单质与A或E单质形成的化合物均为离子化合物
C. A、B两单质反应可得到两种不同的离子化合物
D. B最高价氧化物对应的水化物与0.1mol D单质充分反应放出4.48L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家发明“可充电钠-二氧化碳电池”(如图),放电时电池总反应为:4Na+3CO2 = 2Na2CO3+C。下列说法错误的是

A. 电池工作温度可能在200℃以上
B. 该装置可以将化学能转化为电能
C. 放电时,Na+向正极移动
D. 放电时,正极的电极反应为:4Na++3CO2+4e-=2Na2CO3+C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:

某化学兴趣小组同学模拟该流程设计了如下实验装置:

回答下列问题:
(1)a处可用来检验I中的反应是否发生,选用的试剂是______________,若要停止I中的化学反应,除停止加热外,还要采取的操作是________________________。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O ②可能是CuO;③可能是CuS;④_______。乙同学提出假设①一定不成立,该同学的依据是______;丙同学做了如下实验来验证黑色物质的组成:

基于上述假设分析,黑色物质的组成为__________________________(填化学式)。
(3)II中发生反应的化学方程式为_____________________,实验中通入的SO2不能过量,可能的原因是______________________。
(4)为检验制得的硫代硫酸钠产品的纯度,该小组称取5.0g产品配成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:向锥形瓶中加入25.00mL 0.01mol·L-1的KIO3溶液,再加入过量的KI溶液并酸化,发生反应的离子方程式为___________,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应I2 + 2S2O32- == 2I- + S4O62-,当达到滴定终点时,消耗Na2S2O3溶液20.00mL,则该产品的纯度是____________(保留3个有效数字)。
(5)丁同学提出上述实验装置的设计存在不足,建议在I上__________;在I、II之间增加_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,含有丰富的化学元素。
(1)在电解饱和食盐水的实验中,阳极产物的检验方法是________________________。
(2)目前从海水中提溴(Br 2 )大致有以下步骤。
①向浓缩的海水中通入Cl2,将海水中的 Br- 氧化为 Br2 。
②用热空气将 Br 2 从上述溶液中吹出,并由浓 Na 2 CO 3 溶液吸收,转变为 NaBr、NaBrO 3和CO2 。吸收1 moL Br 2 需消耗 Na2CO3 ________moL。
③再将所得混合溶液用稀硫酸酸化,得到浓度较高的溴水,配平该反应的离子方程式。
____Br— +____ BrO3— +____H + →____ Br2 +____H2O
(3)碘主要从海带中提取,某课外兴趣小组的同学用海带为原料制得少量碘水之后,欲用CCl4从碘水中萃取碘,请简述能用CCl4从碘水中萃取碘的原因是:___________。
(4)同温同浓度的Na2CO3溶液、NaHCO3溶液,PH大小顺序为________ 。NaHCO3溶液中滴入少量氢氧化钠溶液,溶液中c(CO32-)_______(填变大或变小),请用平衡理论解释发生这种变化的原因____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示。
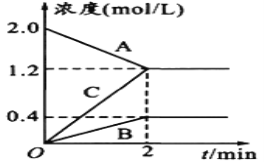
由图中数据
(1)该反应的反应物是___________。
(2)该反应是否可逆反应_____(填“是”或“否”),原因是__________________。写出该反应的化学方程式________________________。
(3)反应开始至2min,用C表示化学平均反应速率为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com