
【题目】某温度时,在2L密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示。
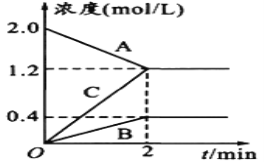
由图中数据
(1)该反应的反应物是___________。
(2)该反应是否可逆反应_____(填“是”或“否”),原因是__________________。写出该反应的化学方程式________________________。
(3)反应开始至2min,用C表示化学平均反应速率为____________________。
【答案】 A 是 平衡时A、B、C三者同时存在 2A![]() B+3C 0.6mol/(L·min)
B+3C 0.6mol/(L·min)
【解析】(1)根据图像可知A的量减少是反应物;(2)根据图像可知反应到2min以后各物质的量不变;物质的量的变化与化学计量数呈正比书写化学方程式;(3)根据v=![]() 计算反应速率。
计算反应速率。
(1)根据图像可知A的量减少是反应物,B、C的量增加,是生成物,故答案为:A;
(2)根据图像可知反应到2min以后各物质的量不变,反应到达平衡时,A、B、C同时存在,是可逆反应;反应到2min时,A的浓度减小量为2.0-1.2=0.8mol/L,B的浓度增加量为0.4mol/L,C的浓度增加量为1.2mol/L,根据物质的量的变化与化学计量数呈正比,则有△n(A):△n(B):△n(C)= △c(A):△c(B):△c(C)=0.8 mol/L:0.4 mol/L:1.2 mol/L =2:1:3,反应的方程式为2A![]() B+3C,故答案为:是;平衡时A、B、C同时存在;2A
B+3C,故答案为:是;平衡时A、B、C同时存在;2A![]() B+3C;
B+3C;
(3)v(C)=![]() =0.6mol/(Lmin),故答案为:0.6mol/(Lmin)。
=0.6mol/(Lmin),故答案为:0.6mol/(Lmin)。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:


(1)几种盐的溶解度见图1。反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行________、________、洗涤、干燥等操作即得K2SO4产品。
(2)检验K2SO4样品是否含有氯化物杂质的实验操作是:_____________________________________。
(3)反应Ⅳ的化学方程式为______________________________________________。
(4)Mn3O4与浓盐酸加热时发生反应的离子方程式为____________________________________________。
(5)图2是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为___________________。
②煅烧过程中固体的锰含量随温度的升高而增大,但当温度超过1000 ℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因:____________________________。
(6)一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂Mn3O4的二氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向________(填“正”或“负”)极移动。电池负极电极反应为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家最近合成第114号元素的原子,该原子的质量数为289,存在时间达到30秒,这项成果具有重要意义.该原子的中子数与质子数之差是( )
A.175
B.114
C.61
D.289
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验.
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化).限选试剂和仪器:0.20mol/LH2C2O4溶液、0.010mol/LKMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 | V(0.20mol/H2 | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 50 | |
② | 2.0 | 0 | 4.0 | 25 | |
③ | 1.0 | a | 4.0 | 25 |
(1)上述实验①②是探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为;乙是实验需要测量的物理量,则表 格中“乙”应填写 .
(2)【测定 H2C2O4xH2O 中 x 值】已知:M(H2C2O4)=90g/mol
①称取 1.260g 纯草酸晶体,将其酸制成 100.00mL 水溶液为待测液.
②取 25.00mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000molL﹣1 的 KMnO 标准溶液进行滴定;
请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如图1,最合理的是(选填 a、b).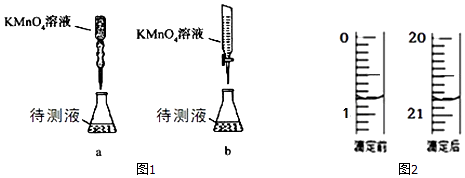
(4)由图2可知消耗 KMnO4溶液体积为mL;
(5)滴定过程中眼睛应注视;
(6)通过上述数据,求得 x= . 以标准 KMnO4溶液滴定样品溶液的浓度,未用标准 KMnO4溶液润洗滴定管,引起实验结果(偏大、偏小或没有影响).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成 HbCO,使血红蛋白 失去输送 O2 功能.CO 进入血液后有如下平衡:CO+HbO2O2+HbCO,已知在人体体温37℃下,该平衡常数为 220.试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以 说明:
(2)抽烟时,进入肺部的空气中 c(CO)=10﹣6mol/L,c(O )=10﹣2mol/L,则 c(HbCO)为 c(HbO2)的倍.
(3)已知当血液中 c(HbCO)的比值大于 0.02 时,人的智力会很快受到损伤,为避免c(HbO2 )
人的智力受到损伤,c(O2)与 c(CO)的比值应大于 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.2g H2含有的氢原子数目为NA
B.常温常压下,22.4L O2含有的分子数目为NA
C.1L 1molL﹣1 KOH溶液中含有的钾离子数目为NA
D.1mol Zn变为Zn2+时失去的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
A.反应①的平衡常数K1= ![]()
B.反应③的平衡常数K= ![]()
C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D.对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com