
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n﹤p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
【答案】C
【解析】试题分析:A.根据图像中“先拐先平,数值大”知,T1<T2,升高温度,C在反应混合物中的体积分数(ф)降低,说明平衡向逆反应方向移动,即正反应方向是放热反应,A错误;B.由图2图像可以看出,在同一温度下,增大压强,C在反应混合物中的体积分数(ф)增大,说明增大压强平衡向正反应方向移动,说明正反应为体积缩小的反应,即m+n>p,B错误;C.在曲线上,当温度一定时,B的转化率也一定,曲线上任意一点都表示达到平衡状态,所以2、4处于平衡状态,v(正)=v(逆),点1在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,即由点1向下引垂直线到曲线上的一点,这样B的转化率要减小,平衡向左移动,故v(正)<v(逆),点3在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,即由点3向上引垂直线到曲线上的一点,这样B的转化率要增大,平衡向右移动,故v(正)>v(逆),C正确;D.a曲线的时间短,反应速率快,催化剂只改变化学反应速率不影响化学平衡,可能为使用了催化剂,但m+n=p,说明反应前后气体的物质的量不变,增大压强,正、逆速率都同等程度增大,到达平衡时间短,不影响平衡,所以a曲线也可能是增大压强,D错误,答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】卤族元素是非常重要的非金属元素,其单质和化合物有广泛用途,化学性质也非常丰富。
(1)基态氯原子的价电子排布式为__________________,其核外电子占据的最高能层的符号是_________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是___________。
(3)ClO2—的立体结构为_______形,中心氯原子的杂化轨道类型为_________,写出ClO2—一个等电子体的化学式 ______。
(4)下列分子中只存在s-p![]() 键的是_____________。
键的是_____________。
A. H2 B.F2 C.HCl D.HClO
(5)CsICl2不稳定,受热时可能按下列两种方式分解,已知生成物晶格能越大反应越易发生,则CsICl2按下列______方式分解更合理。
A.CsICl2=CsI+Cl2 B. CsICl2=CsCl+ICl
(6)由F、K、Mg三种元素形成的某离子晶体的晶胞结构如下图所示,晶胞边长为a nm(1nm=10—9m)。
①该晶体的化学式为___________________。
②该晶体的密度为____________gcm—3。(结果保留1位小数)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料。CO和H2的混合气体俗称合成气,可以在一定条件下制备CH3OH。
(1)若在密闭容器中充入CO和H2,研究其它条件不变时温度对合成甲醇反应影响:CO(g)+2H2(g) ![]() CH3OH(g),实验结果如图所示。
CH3OH(g),实验结果如图所示。
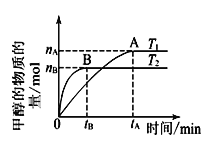
①温度高低比较:T1____T2。
②下列判断正确的是______________。
A.该反应是放热反应
B.该反应在T1时的平衡常数比T2时的小
C.由 T1到T2,ΔS减小
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
③在T1温度时,将1.00molCO和2.00molH2充入1.00L恒容密闭容器中,充分反应达到平衡后,若容器内气体的压强减小到开始时的一半,此时CO的转化率为______________,平衡常数为________________。(填计算结果)
(2)在一个恒容的密闭容器中发生反应CO(g)+2H2(g) ![]() CH3OH(g),在不同时间测定的各成分物质的量浓度如下表:
CH3OH(g),在不同时间测定的各成分物质的量浓度如下表:
时间 | 浓度(mol/L) | ||
c(CO) | c(H2) | c(CH3OH) | |
第0 min | 4.0 | 8.0 | 0 |
第10min | 3.8 | 7.6 | 0.2 |
第20min | 3.4 | 6.8 | 0.6 |
第30min | 3.4 | 6.8 | 0.6 |
第40min | 3.9 | 7.8 | 0.1 |
p>① CO的平均反应速率v(0min~10min)/ v(10min~20min)=________________。
② 若在第30min时改变了反应条件,改变的反应条件可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列装置说法正确的是( )

A. 装置①中,盐桥中的K+移向ZnSO4溶液
B. 滴有酚酞溶液的装置②在电解过程中,b极先变红
C. 可以用装置③在铁上镀铜,d极为铜
D. 装置④中发生铁的吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题。
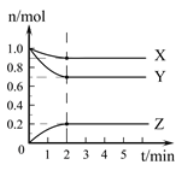
(1)反应开始至2 mim,Y的平均反应速率_________。
(2)分析有关数据,写出X、Y、Z的反应方程式______________________________。
(3)当反应进行了3 min,该反应是否达到平衡___________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250 mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答下列问题:
(1)滴定终点时的现象是_______________________________________。
(2)所配制的250 mL样品液中NaOH的物质的量浓度是_________ mol·L-1;试样中NaOH的质量分数为__________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中充入气体X和Y,发生反应X(g) + Y(g)![]() M(g) + N(g) ΔH,所得实验数据如下表:
M(g) + N(g) ΔH,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.40 | 0.10 | 0.080 |
③ | 800 | 0.20 | 0.05 | a |
下列说法正确的是
A. ①中,若5 min末测得n (M)=0.050 mol,则0至5 min内,用N表示的平均反应速率υ (N)=1.0×10 2 mol/(L·min)
B. 800 ℃,该反应的平衡常数K=2.0
C. ③中,达到平衡时,Y的转化率为80%
D. ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com