

| A. | 正极反应为AgCl+e-═Ag+Cl- | |
| B. | 当电路中转移0.01mole-时,交换膜左侧溶液中约减少0.02mol离子 | |
| C. | 若用NaCl溶液代替盐酸,则电池总反应随之改变 | |
| D. | 放电时,交换膜右侧中有大量白色沉淀生成 |
分析 依据电池总反应为2Ag+Cl2=2AgCl可知,银化合价升高发生氧化反应,氯气中的氯元素化合价降低发生还原反应,所有银做原电池负极,
A.正极氯气得到电子发生还原反应;
B.放电时,银为负极失去电子生成银离子;
C.依据电池总反应为2Ag+Cl2=2AgCl判断;
D.放电时,交换膜左侧的氢离子向右侧移动,银离子在左侧生成AgCl沉淀.
解答 解:A.正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl-,故A错误;
B.放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中共约减少0.02mol离子,故B正确;
C.根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;
D.放电时,交换膜左侧的氢离子向右侧移动,在负极上有银离子生成,银离子在左侧和氯离子反应生成AgCl沉淀,故D错误;
故选:B.
点评 本题考查了原电池原理的应用及沉淀反应,把握原电池原理及正负极的判断和电极方程式的书写是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NH4Cl固体,平衡逆移溶液中c(NH4+)减小 | |
| B. | 加入少量浓盐酸,浓盐酸与 NH3•H2O反应,电离平衡逆移 | |
| C. | 加热,电离平衡逆移 | |
| D. | 加水后,溶液中n(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦②④③ | B. | ①⑤⑦⑥②④③ | C. | ①⑦⑤⑥②④③ | D. | A或B或C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成元素相同,分子结构不同 | |
| B. | 组成元素的质量分数相同,只有化学性质不同 | |
| C. | 具有相同分子量而结构不同 | |
| D. | 具有相同分子量,且组成元素及组成元素的质量分数相同,只是结构不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
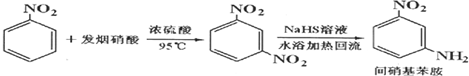
| 参考数据 | 组分 | 邻硝基苯胺 | 间硝基苯胺 | 对硝基苯胺 | 水 | 甲醇 | 硝基苯 |
| 沸点/℃ | 284 | 305.7 | 331.7 | 100 | 64.7 | 4.75 | |
| 偶极矩/D | 4.38 | 4.91 | 6.33 | 1.85 | 1.69 | 4.75 | |
| 颜色 | 橙色 | 淡黄色 | 淡黄色 | 无色 | 无色 | 淡黄色 |

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com