
【题目】有机物甲的结构简式为![]() ,它可以通过下列路线合成(分离方法和其他产物 已经略去)。下列说法不正确的是( )
,它可以通过下列路线合成(分离方法和其他产物 已经略去)。下列说法不正确的是( )
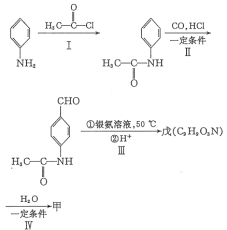
A.甲可以发生取代反应、加成反应
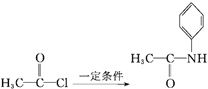
B.步骤Ⅰ的反应方程式是![]() +
+ 
C.步骤Ⅳ的反应类型是取代反应
D.步骤Ⅰ和Ⅳ在合成甲过程中的目的是保护氨基不被氧化
科目:高中化学 来源: 题型:
【题目】扎实的实验知识对学习有机化学至关重要。
(1)实验室用纯溴和苯在铁离子催化下反应制取溴苯,得到粗溴苯后,粗溴苯的精制常进行如下操作:a.蒸馏 b.水洗、分液 c.用干燥剂干燥 d.10%的NaOH溶液碱洗、分液。正确的操作顺序是________。
A.abcdb B.bdbca C.dbcab D.bdabc
分液时上层液体应从________________(填“上口倒出”“下导管直接流出”),蒸馏时所需仪器除酒精灯、温度计、蒸馏烧瓶、牛角管、锥形瓶外还需要的玻璃仪器为______。
(2)下列各组试剂中,能鉴别乙醇、己烷、己烯、乙酸溶液、苯酚溶液等五种无色溶液的是________。
A.金属钠、FeCl3溶液、NaOH溶液
B.新制的Cu(OH)2悬浊液、紫色石蕊溶液
C.紫色石蕊溶液、溴水
D.溴水、新制的Cu(OH)2悬浊液
(3)溴乙烷与氢氧化钠的乙醇溶液共热产生的气体通入酸性高锰酸钾溶液中,溶液褪色,不能说明产生的气体为乙烯的原因是_________。
(4)某有机物的相对分子质量为102,经红外光谱测定,该有机物分子中含有一个羧基、一个羟基和一个碳碳双键,则其可能的结构简式为____(提示:羟基不能连在碳碳双键上)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质既不属于同系物,也不属于同分异构体的是( )
A.CH3-CH2-CH3和CH3-CH2-CH2-CH3
B.CH3CH2CH=CH2和![]()
C.![]() 和
和![]()
D.乙酸和甲酸甲酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。

(1)写出A中反应的化学方程式_______________。
(2)观察到A中的现象是_____________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________,写出有关的化学方程式______________________________。
(4)C中盛放CCl4的作用是________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包裹在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,则融化后的水为淡水。下列叙述正确的是
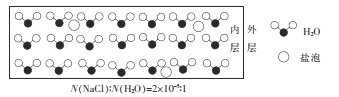
A.海冰内层“盐泡”越少,密度越大
B.海冰冰龄越短,内层的“盐泡”越少
C.每含1mol H2O的海冰内就有2×l0-5 NA个NaCl分子(NA为阿伏加德罗常数)
D.海冰内层NaCl的浓度约为l0-3 mol/L(设冰的密度为0.9 g.cm-3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用洗净的废铜屑作原料来制备硝酸铜。为了防止环境污染,宜采用的方法是
A.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
B.3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
C.2Cu+O2![]() 2CuO;CuO+2HNO3=Cu(NO3)2+H2O
2CuO;CuO+2HNO3=Cu(NO3)2+H2O
D.Cu+2H2OS4(浓)![]() CuSO4+2SO2↑+2H2O;CuSO4+Ba(NO3)2=Cu(NO3)2+BaSO4↓
CuSO4+2SO2↑+2H2O;CuSO4+Ba(NO3)2=Cu(NO3)2+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4HCO3的分解温度是 35℃。以氯化钾和制取二氧化钛的副产品硫酸亚铁为原料生产铁红颜料和过二硫酸铵等,原料的综合利用率较高。其主要流程如下:
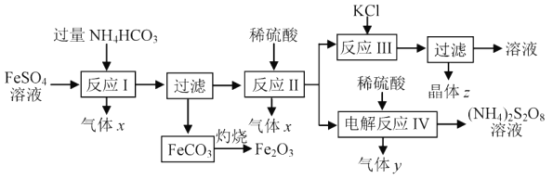
(1)气体x是_________,反应 I 需控制反应温度低于35℃ , 其目的是_______。
(2)反应I的离子方程式为 ___________,FeCO3灼烧的反应方程式为 __________。
(3)各物质的溶解度曲线如图,晶体z是____,简述反应III发生的原因 ________,工业生产上常在反应III的过程中加入一定量的乙醇,其目的是_____________。
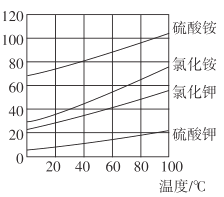
(4)反应IV 常用于生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,气体y是__________,阳极发生的电极反应可表示为_______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃在KOH醇溶液中加热不反应的是( )
①![]() ②
②![]() ③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤
③(CH3)3C—CHBr2 ④CHCl2—CHBr2 ⑤![]() ⑥CH3Cl
⑥CH3Cl
A. ①③⑥B. ②③⑤C. ②④D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品。
(1)标准状况下,1 mol NH3的体积约为________L。
(2)实验室制取NH3的化学方程式为______________。
(3)收集NH3应使用________法,要得到干燥的NH3可选用___做干燥剂。
(4)压强对合成氨反应具有重要的影响。下表是反应达到平衡时压强与 NH3 含量的一些实验数据:
压强MPa | 10 | 20 | 30 | 60 | 100 |
NH3含量(体积分数%) | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
从表中数据可以推断:随着压强增大,平衡时NH3含量随之___(填字母)。
A.增大 B.减小 C.先增大再减小 D.不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com