
【题目】电化学在化学工业中有着广泛应用。根据图示电化学装置,
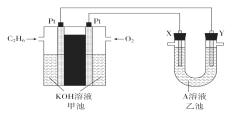
(1)甲池通入乙烷(C2H6)一极的电极反应式为___。
(2)乙池中,若X、Y都是石墨,A是Na2SO4溶液,实验开始时,同时在两极附近溶液中各滴入几滴酚酞溶液,X极的电极反应式为___;一段时间后,在Y极附近观察到的现象是___。
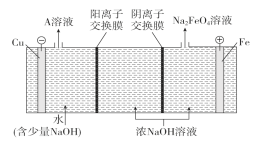
(3)工业上通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,则阳极的电极反应式为__,阴极反应式为___。
【答案】C2H6+18OH--14e-=12H2O+2CO32- 4OH--4e-=O2↑+2H2O 电极表面产生气泡,附近溶液显红色 Fe+8OH--6e-=FeO42-+4H2O 2H2O+2e-=H2↑+2OH-
【解析】
甲池为乙烷燃料电池,所以反应过程中乙烷被氧化,则通入乙烷的一极应为负极,通入氧气的一极为正极;乙池为电解池,X与电池正极相连为阳极,Y与负极相连为阴极。
(1)通入乙烷的一极为负极,乙烷被氧化,由于电解质溶液KOH,所以生成碳酸根和水,电极方程式为:C2H6+18OH--14e-=12H2O+2CO32-;
(2)X为阳极,硫酸钠溶液中水电离出的OH-在阳极放电生成氧气,电极方程式为:4OH--4e-=O2↑+2H2O;Y电极为阴极,水电离出的氢离子在阴极放电生成氢气,水的电离受到促进电离出更多的氢氧根,Y电极附近显碱性,电极附近滴有酚酞,所以可以观察到Y电极附近有气泡产生且溶液显红色;
(3)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O;电解时,水电离的H+在阴极放电生成氢气,电极方程式为:2H2O+2e-=H2↑+2OH-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在300mL的密闭固定容器中,一定条件下发生Ni(s)+4CO(g) ![]() Ni(CO)4(g)的反应,该反应平衡常数(K)与温度(T)的关系如下表所示:
Ni(CO)4(g)的反应,该反应平衡常数(K)与温度(T)的关系如下表所示:
T/℃ | 25 | 80 | 230 |
K | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )。
A.上述生成Ni(CO)4(g)的反应为放热反应
B.230℃时,该反应的正反应为不自发的反应
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol·L-1
D.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去) 如下所示:
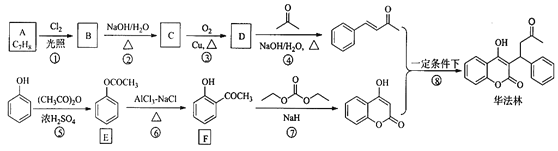
回答下列问题:
(1)A 的名称为________,E 中官能团名称为________。
(2)B 的结构简式为________。
(3)由 C 生成 D 的化学方程式为___________
(4)⑤的反应类型为_________,⑧的反应类型为________。
(5)F 的同分异构体中,同时符合下列条件的同分异构体共有___________种。
a.能与 FeCl3 溶液发生显色反应 b.含有-CHO
其中核磁共振氢谱为五组峰的结构简式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从废旧锂电池中回收Li2SO4、CuSO4、CoSO4等有价金属的工艺流程如下:
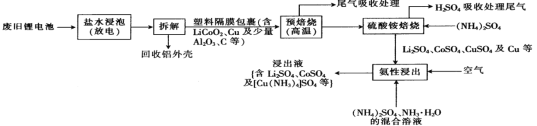
已知:“盐水浸泡”是将废旧锂电池置于食盐水中浸泡放电;“氨性浸出”时溶液呈弱碱性。
回答下列问题:
(1)“盐水浸泡”进行放电,放电的目的是________________________。
(2)“预焙烧”的目的是____________________,可用于吸收该过程产生的尾气的试剂是____________________。
(3)“硫酸铵焙烧”时,硫酸铵的作用是______________________________;“H2SO4吸收处理尾气”后的溶液可循环利用,则“硫酸铵焙烧”时的尾气中含___________(填化学式)。
(4)“氨性浸出”时,通入空气的目的是__________________________。
(5)“氨性浸出”时,Cu单质被浸出为[Cu(NH3)4]SO4,该反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如图所示,下列有关说法正确的是
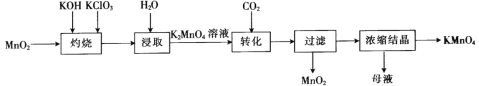
A.“灼烧”时,可在玻璃坩埚中进行
B.“浸取”时,可用无水乙醇代替水
C.“转化”反应中,通入CO2的目的是提供还原剂
D.“浓缩结晶”的目的是分离提纯KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国产航母山东舰已经列装服役,它是采用模块制造然后焊接组装而成的,对焊接有着极高的要求。实验室模拟在海水环境和河水环境下对焊接金属材料使用的影响(如图)。下列相关描述中正确的是
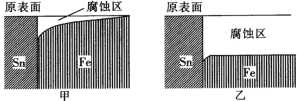
A.由图示的金属腐蚀情况说明了Sn元素的金属性强于Fe元素
B.由图示可以看出甲是海水环境下的腐蚀情况,乙是河水环境下的腐蚀情况
C.两种环境下铁被腐蚀时的电极反应式均为Fe-3e-=Fe3+
D.为了防止舰艇在海水中被腐蚀,可在焊点附近用锌块打“补丁”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果发现了原子序数为114的元素,下列对它的叙述中正确的是( )
①位于第七周期②非金属元素③最外电子层有4个电子④没有放射性⑤属于第IVA族元素⑥属于锕系元素.
A.①③⑤B.②⑥C.①③⑥D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中短周期的一部分,A、B、C三种元素原子核外的电子数之和等于B原子的质量数。B原子核内的质子数和中子数相等。下列叙述不正确的是( )
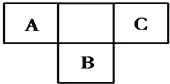
A.A C B三种元素分别为氮、氟、硫
B.A元素最高价氧化物对应的水化物具有强氧化性
C.B元素的氧化物、氢化物的水溶液都呈强酸性
D.C元素是非金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com