
����Ŀ���Ѽ��ѺϽ��ں��պ�����Ǿ�����Ҫ��Ӧ�ü�ֵ����������Ҫ�ɷ�Ϊ��������(FeTiO3)������������SiO2��Fe2O3�����ʡ���������Ϊԭ���Ʊ��ѵĹ�����������ͼ��ʾ��

(1)Ϊ������������ʱ�Ľ����ʣ����˲���ѭ����ȡ���ӳ�ʱ�䡢�ۿ�����⣬�����Բ���______________________(дһ�ַ���)��
(2)���������������ѡ��������ʵ�Ӱ����ͼ��ʾ���ݴ��жϣ����ʱ�����������������ӦΪ___________��

��������Ҫ�ɷ���Ũ���ᷴӦ����Ҫ������TiOSO4��FeSO4���÷�Ӧ�Ļ�ѧ����ʽ��______________________��
(3)�������Ͽ�֪��TiO2+��Fe3+ˮ��ת��Ϊ������pH�ӽ�����Ӧ��Fe3++H2Y2===FeY��+2H+��K=1024.3)����Ӧ��TiO2++H2Y2��=== TiO Y2��+2H+��K=1017.3����������Һ��EDTA(H2Y2��)�������ٵ���pH��TiO2+ˮ������ƫ����[TiO (OH)2]��������TiO2+ˮ������ӷ���ʽΪ��___________��Fe3+δת��Ϊ������ԭ����______________________��
(4)������Һ2��___________��ȴ�ᾧ������һϵ�в������ɻ�ø���Ʒ�̷�(FsO4��7H2O)����Һ2���������ɷ���������ʹ�õ�������______________________��
(5)������ͼ��ʾװ����һ����������TiO2��ȡ�����ѵĻ�ѧ����ʽΪ__________________�������ĵ缫��ӦʽΪ______________________��

���𰸡��������裨���ʵ������¶ȵĺ����𰸾����֣� 80~85% FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O TiO2-+2H2O![]() TiO(OH)2+2H+ ��Ӧ�ٵ�KԶ���ڷ�Ӧ�ڣ�Fe3+��Ҫת��ΪFeY- ����Ũ�� H2SO4 TiO2
TiO(OH)2+2H+ ��Ӧ�ٵ�KԶ���ڷ�Ӧ�ڣ�Fe3+��Ҫת��ΪFeY- ����Ũ�� H2SO4 TiO2![]() O2��+Ti 2O2��4e-=O2��
O2��+Ti 2O2��4e-=O2��
��������
(1)������������ʱ�Ľ����ʣ����ӿ췴Ӧ���ʣ���������������ʵ������¶ȣ�
(2)��ͼ��֪��������������Ϊ80~85%ʱ�ѡ�����������ߣ�FeTiO3��Ũ���ᷴӦ����TiOSO4��FeSO4��
(3)TiO2+ˮ������TiO(OH)2�����ڷ�Ӧ�ٵ�KԶ���ڷ�Ӧ�ڣ�Fe3+��Ҫת��ΪFeY-��Fe3+δת��Ϊ������
(4)�����̿�֪����Һ2����FeSO4��ʣ�����ᣬ������Ũ������ȴ�ᾧ������һϵ�в������ɻ�ø���Ʒ�̷�(FsO4��7H2O)����Һ2���������ɷ���������ʹ�õ�������H2SO4��
(5)��װ��Ϊ���װ�ã���TiO2��ȡ�����ѣ���������������Ӧ��
(1)������������ʱ�Ľ����ʣ����ӿ췴Ӧ���ʣ���������������ʵ������¶ȣ�
�ʴ�Ϊ������������ʵ������¶ȣ�
(2)��ͼ��֪��������������Ϊ80~85%ʱ�ѡ�����������ߣ�
FeTiO3��Ũ���ᷴӦ����TiOSO4��FeSO4����ѧ����ʽΪ��FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O��
�ʴ�Ϊ��80~85%��FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O��
(3)TiO2+ˮ������TiO(OH)2�����ӷ���ʽΪ��TiO2-+2H2O![]() TiO(OH)2+2H+�����ڷ�Ӧ�ٵ�KԶ���ڷ�Ӧ�ڣ�Fe3+��Ҫת��ΪFeY-��Fe3+δת��Ϊ������
TiO(OH)2+2H+�����ڷ�Ӧ�ٵ�KԶ���ڷ�Ӧ�ڣ�Fe3+��Ҫת��ΪFeY-��Fe3+δת��Ϊ������
�ʴ�Ϊ��TiO2-+2H2O![]() TiO(OH)2+2H+����Ӧ�ٵ�KԶ���ڷ�Ӧ�ڣ�Fe3+��Ҫת��ΪFeY-��
TiO(OH)2+2H+����Ӧ�ٵ�KԶ���ڷ�Ӧ�ڣ�Fe3+��Ҫת��ΪFeY-��
(4)�����̿�֪����Һ2����FeSO4��ʣ�����ᣬ������Ũ������ȴ�ᾧ������һϵ�в������ɻ�ø���Ʒ�̷�(FsO4��7H2O)����Һ2���������ɷ���������ʹ�õ�������H2SO4��
�ʴ�Ϊ������Ũ����H2SO4��
(5)��װ��Ϊ���װ�ã���TiO2��ȡ�����ѣ���ѧ����ʽΪTiO2![]() O2��+Ti����������������Ӧ���缫��ӦʽΪ2O2��4e-=O2����
O2��+Ti����������������Ӧ���缫��ӦʽΪ2O2��4e-=O2����
�ʴ�Ϊ��TiO2![]() O2��+Ti��2O2��4e-=O2����
O2��+Ti��2O2��4e-=O2����


 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪0.5L��NaCl��Һ�к���0.5molNa+�����й��ڸ���Һ��˵������ȷ���ǣ� ��
A. ����Һ�����ʵ����ʵ���Ũ��Ϊ1 mol��L-1
B. ����Һ�к���58.5gNaCl
C. ����1000mL����Һ����58.5gNaCl
D. ��ȡ100mL����Һ�����ձ��У��ձ���Na+�����ʵ���Ϊ0.1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡ���Ʊ�̼��ﮣ�������ߺ�ˮ���ۺ����ü�ֵ�����㹤ҵ�϶�̼��﮵������Ʊ�̼��﮵�һ�ֹ����������£�

��֪���ٺ�ˮ��ijЩ����Ũ�����£�
���� | Li+ | Mg2+ | Ca2+ | Mn2+ | Cl- |
Ũ��(mol/L) | 0.113 | 0.049 | 0.001 | 0.010 | 0.501 |
��̼��﮵��ܽ�ȣ�
�¶�(��) | 0 | 10 | 30 | 50 | 70 | 90 |
�ܽ��(g/L) | 1.54 | 1.43 | 1.25 | 1.08 | 0.91 | 0.83 |
![]() �������ܵ���ʵ��ܶȻ�(25��)��
�������ܵ���ʵ��ܶȻ�(25��)��
���� | Li2CO3 | MgCO3 | MnCO3 | CaCO3 | Mg(OH)2 |
Ksp | 2.5��10-2 | 6.8��10-6 | 2.3��10-11 | 2.8��10-9 | 6��10-10 |
��ش��������⣺
![]() ���Ƴ��ӽε�����ΪMgCO3��______
���Ƴ��ӽε�����ΪMgCO3��______![]() д��ѧʽ
д��ѧʽ![]()
![]() ��HCl��pHΪ4��5��Ŀ����_________��
��HCl��pHΪ4��5��Ŀ����_________��
![]() ���γ�þ�����У���ʹMg2+Ũ��Ϊ6��10-4mol/L��Ӧ����pHΪ______��
���γ�þ�����У���ʹMg2+Ũ��Ϊ6��10-4mol/L��Ӧ����pHΪ______��
![]() ��﮽Σ�ʵ�ʲ�ò�ͬ��������������µ�̼��﮳���������±���
��﮽Σ�ʵ�ʲ�ò�ͬ��������������µ�̼��﮳���������±���
��� |
| ��������(g) | Li2CO3����(%) | ﮻�����(%) |
0.9:2.0 | 10.09 | 92.36 | 77.67 | |
1.0:2.0 | 10.97 | 90.19 | 82.46 | |
1.1:2.0 | 11.45 | 89.37 | 85.27 | |
1.2:2.0 | 12.14 | 84.82 | 85.85 |
�ۺ�������Ϣ������ʵ������ʱ��ԭ�ϳɱ���Ӧ����______![]() �����
�����![]() ��CO32-��Li+���ʵ���֮�ȼ��봿���Ʊ�̼��ﮡ�
��CO32-��Li+���ʵ���֮�ȼ��봿���Ʊ�̼��ﮡ�
![]() ����¶��������
����¶��������![]() ����Ҫԭ����______��
����Ҫԭ����______��
![]() ̼���ֽ�������Ϊ������̼�����ˮ�Ľ�����ͨ��CO2���壬��ַ�Ӧ���ˣ��ڼ�����Һʹ��ֽ⡣д���ڷ�Ӧ�еĻ�ѧ����ʽ��__________��д����̼���ֽ��п�ѭ���������ʵĵ���ʽ��_________��
̼���ֽ�������Ϊ������̼�����ˮ�Ľ�����ͨ��CO2���壬��ַ�Ӧ���ˣ��ڼ�����Һʹ��ֽ⡣д���ڷ�Ӧ�еĻ�ѧ����ʽ��__________��д����̼���ֽ��п�ѭ���������ʵĵ���ʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������ɵı仯���ɣ����бȽ��У���ȷ���ǣ� ��
A. ���ԣ�H2CO3��HNO3��H3PO4B. �����ԣ�N2��O2��F2
C. ԭ�Ӱ뾶��Br��Cl��FD. �����ԣ�Al��Ng��Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������MgCl2 ��Һ�� FeCl3��Һ���й�˵��������ȷ����
A. ����FeCl3��Һʱ��Ϊ�˷�ֹ��Һ���ֻ��ǣ���������Һ�е�����������
B. Ϊ�˳�ȥMgCl2������Һ�е�FeCl3�����ڼ��Ƚ���������¼���MgCO3�����˺�������Һ�м�����������
C. ��FeCl3��Һ��FeCl3���壬ˮ��ƽ�������ƶ���FeCl3ˮ��̶�����
D. ��FeCl3��Һ��ˮ����Һ��ɫ��dz��FeCl3ˮ��̶�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ��
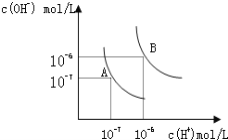
��1������A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ� ���¶�����100��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬���ʱˮ�����ӻ���_____________���ӵ�_____________��
��2������100���ĺ��£���pH=8��Ba(OH)2��Һ��pH=5��ϡ�����ϣ���ʹ�����ҺpH=7����Ba(OH)2������������Ϊ____________________��
��3�����ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ�д�������Ӻ�������Ũ����ȣ����Ϻ���Һ��________�������������������������������������������____________����������Һ����������� >�� ������������<�� ����
��4����֪ij��Һ��ֻ����OH-��H+��NH4+��Cl-�������ӣ�ijͬѧ�Ʋ����Һ�и�����Ũ�ȴ�С˳��������������ֹ�ϵ��
A��c(Cl-)��c(NH4+)��c(H+)��c(OH-) B��c(Cl-)��c(NH4+)��c(OH-)��c(H+)
C��c(Cl-)��c(H+)��c(NH4+)��c(OH-) D��c(NH4+)��c(Cl-)��c(OH-)��c(H+)
������Һ��ֻ�ܽ���һ�����ʣ���������Ũ�ȴ�С��ϵ����ȷ���ǣ�ѡ����ĸ��________��
����������ϵ��D����ȷ�ģ�����Һ�е�����Ϊ____________________��
������ˮ�м���ϡ��������Һ��pH=7����ʱc(NH4+)=a mol/L����c(SO42-)= _____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CH3OCH3)��һ�����˻���ԭ�ϣ����м�����Ӧ���ܡ�
l.�����ѵ�������
�����ѵ�����ԭ��֮һ�����ü״���ˮ�ɶ����ѣ���ѧ����ʽ���£�
��Ӧi 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ��H1
CH3OCH3(g)+H2O(g) ��H1
(1)��֪���״��������ѵ���̬��ȼ���ȷֱ�Ϊ��761.5kJ��mol��1����1455.2kJ��mol��1����H2O(g)=H2O(1) ��H=��44.0kJ��mol��1��
��Ӧi�ġ�H1=___________ kJ��mol��1��
(2)��Ӧi�м״�ת���ʡ�������ѡ���Եİٷ����벻ͬ�����Ĺ�ϵ��ͼ1��ʾ������ʱ��ѡ�����Ѵ�����___________��


(3)ѡ���������ƽ��ʱ�ļ״�ת�������¶ȵĹ�ϵ��ͼ2��ʾ�����о�����ĵ���ɫ��ͼ���ָù�����Ҫ���ڵĸ���ӦΪ��
��Ӧii 2CH3OH(g)![]() C2H4(g)+2H2O(g) ��H2=��29.1kJ��mol��1
C2H4(g)+2H2O(g) ��H2=��29.1kJ��mol��1
�ٹ�ҵ�����������ѵ��¶�ͨ����270��300�棬����330��֮�״�ת�����½������ݻ�ѧƽ���ƶ�ԭ������ԭ����______________________�����ݻ�ѧ��Ӧ���ʱ仯����ԭ����______________________��
��ij�¶��£���CH3OH(g)Ϊԭ�ϣ�ƽ��ʱ�����ʵķ�ѹ�������±���

��Ӧi�У�CH3OH(g)��ƽ��ת���ʦ�=___________����Ӧi��ƽ�ⳣ��Kp=__________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣻���������λ��Ч����)
��.�����ѵ�Ӧ�ã�
(4)ͼ3Ϊ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��

�ٸõ�صĸ�����ӦʽΪ��______________________��
����������ȼ�ϵ�ص����������Һ������4.6g�����Ѻ��ܹ����ڵ��������ռ���13.44L(���)���壬����װ�õ�����������Ϊ___________��(����3λ��Ч����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں����ܱ������У���10 mol CO��һ������H2S��ϼ��Ȳ��ﵽ����ƽ�⣺CO(g)��H2S(g) ![]() COS(g)��H2(g) K��1��ƽ���CO���ʵ���Ϊ8 mol������˵����ȷ����
COS(g)��H2(g) K��1��ƽ���CO���ʵ���Ϊ8 mol������˵����ȷ����
A. CO��H2S��ת����֮��Ϊ1:1
B. ��ƽ���H2S���������Ϊ4%
C. �����¶ȣ�COSŨ�ȼ�С�������÷�Ӧ�����ȷ�Ӧ
D. ��������ƽ����ϵ���ټ���CO��H2S��COS��H2��1 mol��ƽ�ⲻ�ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com