
����Ŀ���ں����ܱ������У���10 mol CO��һ������H2S��ϼ��Ȳ��ﵽ����ƽ�⣺CO(g)��H2S(g) ![]() COS(g)��H2(g) K��1��ƽ���CO���ʵ���Ϊ8 mol������˵����ȷ����
COS(g)��H2(g) K��1��ƽ���CO���ʵ���Ϊ8 mol������˵����ȷ����
A. CO��H2S��ת����֮��Ϊ1:1
B. ��ƽ���H2S���������Ϊ4%
C. �����¶ȣ�COSŨ�ȼ�С�������÷�Ӧ�����ȷ�Ӧ
D. ��������ƽ����ϵ���ټ���CO��H2S��COS��H2��1 mol��ƽ�ⲻ�ƶ�
���𰸡�B
��������
��ӦǰCO�����ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol���跴ӦǰH2S���ʵ���Ϊn����
CO(g)��H2S(g) ![]() COS(g)��H2(g)
COS(g)��H2(g)
��ʼ��mol����10 n 0 0
�仯��mol����2 2 2 2
ƽ�⣨mol����8 n-2 2 2
���¶��¸÷�Ӧ��K=1���������ʵ�������Ũ�ȴ���ƽ�ⳣ������ʽ�����n�����ݼ���������ѧƽ���Ӱ�����ؽ����ж���
��ӦǰCO�����ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol���跴ӦǰH2S���ʵ���Ϊn����
CO(g)��H2S(g) ![]() COS(g)��H2(g)
COS(g)��H2(g)
��ʼ��mol����10 n 0 0
�仯��mol����2 2 2 2
ƽ�⣨mol����8 n-2 2 2
���¶��¸÷�Ӧ��K=1���������ݻ�ΪV����ƽ�ⳣ��K= ��
��
��ã�n=2.5������Ӧǰ��������ʵ���Ϊ2.5mol��
A�����ڷ�ӦǰCO��H2S�����ʵ����ֱ�Ϊ10mol��2.5mol��������ѧ��������ȣ���Ӧ���ĵ����ʵ�����ȣ����Զ��ߵ�ת����һ������ȣ���A����
B���÷�Ӧǰ������������ȣ���Ӧ������������ʵ������䣬��ȻΪ10mol+2.5mol=12.5mol��ƽ�����������ʵ���Ϊ��2.5-2��mol=0.5mol����ͬ������������������=���ʵ�������=0.5mol/12.5mol��100%=4.0%����B��ȷ��
C�������¶ȣ�COSŨ�ȼ�С��˵��ƽ�����������ƶ�����÷�Ӧ������ӦΪ���ȷ�Ӧ����C����
D����������ƽ����ϵ���ټ���CO��H2S��COS��H2��1 mol�����ʱ�÷�Ӧ��Ũ����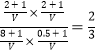 <1��˵��ƽ������������ƶ�����D������
<1��˵��ƽ������������ƶ�����D������
��ѡB��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѽ��ѺϽ��ں��պ�����Ǿ�����Ҫ��Ӧ�ü�ֵ����������Ҫ�ɷ�Ϊ��������(FeTiO3)������������SiO2��Fe2O3�����ʡ���������Ϊԭ���Ʊ��ѵĹ�����������ͼ��ʾ��

(1)Ϊ������������ʱ�Ľ����ʣ����˲���ѭ����ȡ���ӳ�ʱ�䡢�ۿ�����⣬�����Բ���______________________(дһ�ַ���)��
(2)���������������ѡ��������ʵ�Ӱ����ͼ��ʾ���ݴ��жϣ����ʱ�����������������ӦΪ___________��

��������Ҫ�ɷ���Ũ���ᷴӦ����Ҫ������TiOSO4��FeSO4���÷�Ӧ�Ļ�ѧ����ʽ��______________________��
(3)�������Ͽ�֪��TiO2+��Fe3+ˮ��ת��Ϊ������pH�ӽ�����Ӧ��Fe3++H2Y2===FeY��+2H+��K=1024.3)����Ӧ��TiO2++H2Y2��=== TiO Y2��+2H+��K=1017.3����������Һ��EDTA(H2Y2��)�������ٵ���pH��TiO2+ˮ������ƫ����[TiO (OH)2]��������TiO2+ˮ������ӷ���ʽΪ��___________��Fe3+δת��Ϊ������ԭ����______________________��
(4)������Һ2��___________��ȴ�ᾧ������һϵ�в������ɻ�ø���Ʒ�̷�(FsO4��7H2O)����Һ2���������ɷ���������ʹ�õ�������______________________��
(5)������ͼ��ʾװ����һ����������TiO2��ȡ�����ѵĻ�ѧ����ʽΪ__________________�������ĵ缫��ӦʽΪ______________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ���������з�Ӧ��2KMnO4+16HCl(Ũ)=2MnCl2+2KCl+5Cl2��+8H2O
��1���÷�Ӧ����������____������ԭ��Ԫ����______������������_______��
��2���õ����ŷ��������ת�Ƶķ������Ŀ��2KMnO4+16HCl��Ũ��=2MnCl2+2KCl+5Cl2��+8H2O______
��3���÷�Ӧ��1molKMnO4�μӷ�Ӧ����������HClΪ____mol��ת�Ƶ���____mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ���������ᴿ��װ�ã������װ�ûش����⣺

(1)��װ��C��D�ж��õ���������װ��C�в�������������___________��װ��D�в�������������___________��
(2)װ��A�еĢٵ���������___________����ȴˮ�ķ�����___________��װ��B�ڷ�ҺʱΪ��Һ��˳�����£�Ӧ���еIJ�����______________________��
(3)���Ȼ�����Һ�еõ��Ȼ��ƹ��壬Ӧѡ��___________�������װ��ͼ����ĸ����ͬ������ȥ����ˮ�е�Cl-�����ʣ�ѡ��װ��__________����������ˮ��Cl-�Ƿ�����ķ�����ȡ������ƿ�е�ˮ�ڽྻ�Թ��У��μ�___________����������ɫ��������Cl-�ѳ������ӵ�ˮ�з����I2��ѡ��װ��___________���÷��뷽����������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�鰴��������̽�������ȡ������������ȡ�������£�

(1)�ٷ�Һ©��ʹ��ǰ���©����©������_____________________��
�ڲ���X�У���ȡ���Һ©���ڹ۲쵽��������_________________��
�������йز���Y��˵����ȷ����_____��
a.Ӧ����NaOH��Һ��Ũ�Ⱥ���� b.����ת�������ӽ���ˮ��
c.��Ҫ�dz�ȥ������ȡԭҺ�е��л����� d.NaOH��Һ�������Ҵ�����
��ʵ���в���Z��������___________��
(2)ʵ����в�����������������____________________________��
(3)����ȡ���õ��IJ���������________________������ȡ��ԭ����______________������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ��ص�������ȷ���ǣ� ��
A. ����ԭ��ص������������������ֲ�ͬ�Ľ���
B. ԭ�����������һ�����ƶ�
C. ��ԭ����У�����������һ���Ǹ������õ缫������ԭ��Ӧ
D. ԭ��طŵ�ʱ�������ķ����ǴӸ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ��﮷��������ȵ��װ�ã�����ܷ�ӦΪxLi+LiV3O8=Li1+xV3O8������ʱ������������������ط�Ӧʹ�������ۻ�������˵������ȷ����

A. ��װ�õ��Ӧ������ˮ�������������½���
B. �������̵�����ת���漰��ѧ��ת��Ϊ���ܺ͵���
C. �ŵ�ʱLiV3O8�缫��ӦΪ��xLi++LiV3O8-xe-=Li1+xV3O8
D. ���ʱCl����LiV3O8�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2(g)+Cl2(g)=2HCl(g) ��H=-184.6kJ��mol-1�� ��ӦHCl(g)=1/2H2(g)+1/2Cl2(g)����HΪ
A. +184.6kJ��mol-1B. -92.3kJ��mol-1
C. -369.2kJ��mol-1D. +92.3kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ȡ-��Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ������������ͼ��
�ٸ�ͬѧ�����õ���ȡ��������______������ţ���
A. �ƾ� B. �� C. ���Ȼ�̼ D. ����
��. �����ȡ������ ��. ���÷ֲ�
��. ���÷ֲ� ��. ����
��. ����
�ڼס��ҡ���3��ʵ������У�����ȷ����____________����ס������ҡ���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com