
ЁОЬтФПЁПЪЕбщЪвжЦШЁТШЦјгаЯТСаЗДгІЃК2KMnO4+16HCl(ХЈ)=2MnCl2+2KCl+5Cl2Ёќ+8H2O
ЃЈ1ЃЉИУЗДгІжабѕЛЏМСЪЧ____ЃЛБЛЛЙдЕФдЊЫиЪЧ______ЃЛбѕЛЏВњЮяЪЧ_______ЁЃ
ЃЈ2ЃЉгУЕЅЯпЧХЗЈБъГіЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПЃК2KMnO4+16HClЃЈХЈЃЉ=2MnCl2+2KCl+5Cl2Ёќ+8H2O______
ЃЈ3ЃЉИУЗДгІга1molKMnO4ВЮМгЗДгІЃЌБЛбѕЛЏЕФHClЮЊ____molЃЌзЊвЦЕчзг____molЁЃ
ЁОД№АИЁПKMnO4 Mn Cl2 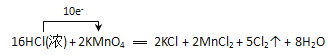 5 5
5 5
ЁОНтЮіЁП
(1)2KMnO4+16HCl(ХЈ)=2MnCl2+2KCl+5Cl2Ёќ+8H2OжаЃЌMnдЊЫиЕФЛЏКЯМлНЕЕЭЃЌClдЊЫиЕФЛЏКЯМлЩ§ИпЃЌНсКЯбѕЛЏЛЙдЗДгІЕФЙцТЩЗжЮіНтД№ЃЛ
(2)ИљОнЛЏКЯМлЕФБфЛЏЗжЮіХаЖЯГіЛЙдМСКЭбѕЛЏМСЃЌвдМАзЊвЦЕФЕчзгЪ§ЃЌдйИљОнЕЅЯпЧХЕФЪщаДЗНЪННтД№ЃЛ
(3)НсКЯ(2)ЕФНсЙћЗжЮіНтД№ЁЃ
(1)2KMnO4+16HCl(ХЈ)=2MnCl2+2KCl+5Cl2Ёќ+8H2OжаЃЌMnдЊЫиЕФЛЏКЯМлНЕЕЭЃЌБЛЛЙдЃЌЗДгІЕУЕНЕФЪЧЛЙдВњЮяЃЌKMnO4ЪЧбѕЛЏМСЃЌClдЊЫиЕФЛЏКЯМлЩ§ИпЃЌБЛбѕЛЏЃЌЗДгІЕУЕНЕФбѕЛЏВњЮяЮЊCl2ЃЌЙЪД№АИЮЊЃКKMnO4ЃЛMnЃЛCl2ЃЛ
(2)ЗДгІжаЃЌЛЏКЯМлЩ§ИпЕФдЊЫиЪЧТШдЊЫиЃЌЪЇЕчзгЃЌHClЮЊЛЙдМСЃЌЛЏКЯМлНЕЕЭдЊЫиЪЧУЬдЊЫиЃЌЕУЕНЕчзгЃЌKMnO4ЪЧбѕЛЏМСЃЌЛЏКЯМлЩ§ИпЕФЪ§ФП=ЛЏКЯМлНЕЕЭЕФЪ§ФП=зЊвЦЕчзгЪ§=10ЃЌЗДгІжаЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПгУЕЅЯпЧХБэЪОЮЊ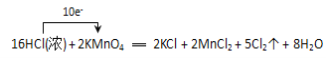 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК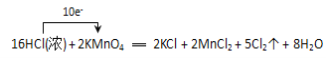 ЃЛ
ЃЛ
(3)ИљОнЗНГЬЪН2KMnO4+16HCl(ХЈ)=2MnCl2+2KCl+5Cl2Ёќ+8H2OЃЌЗДгІга2molKMnO4ВЮМгЗДгІЃЌЯћКФHCl16molЃЌЦфжаБЛбѕЛЏЕФHClЮЊ10molЃЌзЊвЦЕчзг10molЃЌЫљвдШєИУЗДгІга1molKMnO4ВЮМгЗДгІЃЌБЛбѕЛЏЕФHClЮЊ5molЃЌзЊвЦЕчзгЪ§5molЃЌЙЪД№АИЮЊЃК5ЃЛ5ЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПДгКЃЫЎжаЬсШЁВЂжЦБИЬМЫсяЎЃЌПЩвдЬсИпКЃЫЎЕФзлКЯРћгУМлжЕЃЌТњзуЙЄвЕЩЯЖдЬМЫсяЎЕФашЧѓЁЃжЦБИЬМЫсяЎЕФвЛжжЙЄвеСїГЬШчЯТЃК

вбжЊЃКЂйКЃЫЎжаФГаЉРызгХЈЖШШчЯТЃК
Рызг | Li+ | Mg2+ | Ca2+ | Mn2+ | Cl- |
ХЈЖШ(mol/L) | 0.113 | 0.049 | 0.001 | 0.010 | 0.501 |
ЂкЬМЫсяЎЕФШмНтЖШЃК
ЮТЖШ(Ёц) | 0 | 10 | 30 | 50 | 70 | 90 |
ШмНтЖШ(g/L) | 1.54 | 1.43 | 1.25 | 1.08 | 0.91 | 0.83 |
![]() МИжжФбШмЕчНтжЪЕФШмЖШЛ§(25Ёц)ЃК
МИжжФбШмЕчНтжЪЕФШмЖШЛ§(25Ёц)ЃК
ЮяжЪ | Li2CO3 | MgCO3 | MnCO3 | CaCO3 | Mg(OH)2 |
Ksp | 2.5ЁС10-2 | 6.8ЁС10-6 | 2.3ЁС10-11 | 2.8ЁС10-9 | 6ЁС10-10 |
ЧыЛиД№ЯТСаЮЪЬтЃК
![]() ОЋжЦГ§дгНзЖЮЕФТЫдќЮЊMgCO3ЁЂ______
ОЋжЦГ§дгНзЖЮЕФТЫдќЮЊMgCO3ЁЂ______![]() аДЛЏбЇЪН
аДЛЏбЇЪН![]()
![]() гУHClЕїpHЮЊ4ЁЋ5ЕФФПЕФЪЧ_________ЁЃ
гУHClЕїpHЮЊ4ЁЋ5ЕФФПЕФЪЧ_________ЁЃ
![]() ЖўДЮГ§УОЙ§ГЬжаЃЌШєЪЙMg2+ХЈЖШЮЊ6ЁС10-4mol/LЃЌгІПижЦpHЮЊ______ЁЃ
ЖўДЮГ§УОЙ§ГЬжаЃЌШєЪЙMg2+ХЈЖШЮЊ6ЁС10-4mol/LЃЌгІПижЦpHЮЊ______ЁЃ
![]() ГСяЎНзЖЮЃЌЪЕМЪВтЕУВЛЭЌДПМюМгШыСПЬѕМўЯТЕФЬМЫсяЎГСЕэНсЙћШчЯТБэЃК
ГСяЎНзЖЮЃЌЪЕМЪВтЕУВЛЭЌДПМюМгШыСПЬѕМўЯТЕФЬМЫсяЎГСЕэНсЙћШчЯТБэЃК
ађКХ |
| ГСЕэжЪСП(g) | Li2CO3КЌСП(%) | яЎЛиЪеТЪ(%) |
0.9:2.0 | 10.09 | 92.36 | 77.67 | |
1.0:2.0 | 10.97 | 90.19 | 82.46 | |
1.1:2.0 | 11.45 | 89.37 | 85.27 | |
1.2:2.0 | 12.14 | 84.82 | 85.85 |
злКЯвдЩЯаХЯЂМАПМТЧЪЕМЪЩњВњЪБЕФдСЯГЩБОЃЌгІАДее______![]() ЬюађКХ
ЬюађКХ![]() жаCO32-гыLi+ЮяжЪЕФСПжЎБШМгШыДПМюжЦБИЬМЫсяЎЁЃ
жаCO32-гыLi+ЮяжЪЕФСПжЎБШМгШыДПМюжЦБИЬМЫсяЎЁЃ
![]() ГСяЎЮТЖШашПижЦдк
ГСяЎЮТЖШашПижЦдк![]() ЃЌжївЊдвђЪЧ______ЁЃ
ЃЌжївЊдвђЪЧ______ЁЃ
![]() ЬМЛЏЗжНтОпЬхЙ§ГЬЮЊЃКЂйЯђЬМЫсяЎгыЫЎЕФНЌСЯжаЭЈШыCO2ЦјЬхЃЌГфЗжЗДгІКѓЃЌЙ§ТЫЃЛЂкМгШШТЫвКЪЙЦфЗжНтЁЃаДГіЂкЗДгІжаЕФЛЏбЇЗНГЬЪНЃК__________ЁЃаДГідкЬМЛЏЗжНтжаПЩбЛЗРћгУЮяжЪЕФЕчзгЪНЃК_________ЁЃ
ЬМЛЏЗжНтОпЬхЙ§ГЬЮЊЃКЂйЯђЬМЫсяЎгыЫЎЕФНЌСЯжаЭЈШыCO2ЦјЬхЃЌГфЗжЗДгІКѓЃЌЙ§ТЫЃЛЂкМгШШТЫвКЪЙЦфЗжНтЁЃаДГіЂкЗДгІжаЕФЛЏбЇЗНГЬЪНЃК__________ЁЃаДГідкЬМЛЏЗжНтжаПЩбЛЗРћгУЮяжЪЕФЕчзгЪНЃК_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫЎЕФЕчРыЦНКтЧњЯпШчЭМЫљЪОЁЃ
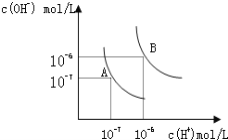
ЃЈ1ЃЉШєвдAЕуБэЪО25ЁцЪБЫЎдкЕчРыЦНКтЪБЕФРызгХЈЖШЃЌ ЕБЮТЖШЩ§ЕН100ЁцЪБЃЌЫЎЕФЕчРыЦНКтзДЬЌЕНBЕуЃЌдђДЫЪБЫЎЕФРызгЛ§Дг_____________діМгЕН_____________ЁЃ
ЃЈ2ЃЉБЃГж100ЁцЕФКуЮТЃЌНЋpH=8ЕФBa(OH)2ШмвКгыpH=5ЕФЯЁбЮЫсЛьКЯЃЌгћЪЙЛьКЯШмвКpH=7ЃЌдђBa(OH)2гыбЮЫсЕФЬхЛ§БШЮЊ____________________ЁЃ
ЃЈ3ЃЉЮяжЪЕФСПХЈЖШЯрЭЌЕФДзЫсКЭЧтбѕЛЏФЦШмвКЛьКЯКѓЃЌШмвКжаДзЫсИљРызгКЭФЦРызгХЈЖШЯрЕШЃЌдђЛьКЯКѓШмвКГЪ________ЃЈЬюЁАЫсадЁБЃЌЁАжаадЁБЛђЁАМюадЁБЃЉЃЌДзЫсЬхЛ§____________ЧтбѕЛЏФЦШмвКЬхЛ§ЁЃЃЈЬюЁА >ЁБ ЛђЁАЃНЁБЛђЁА<ЁБ ЃЉЁЃ
ЃЈ4ЃЉвбжЊФГШмвКжажЛДцдкOH-ЁЂH+ЁЂNH4+ЁЂCl-ЫФжжРызгЃЌФГЭЌбЇЭЦВтИУШмвКжаИїРызгХЈЖШДѓаЁЫГађПЩФмгаШчЯТЫФжжЙиЯЕЃК
AЃЎc(Cl-)ЃОc(NH4+)ЃОc(H+)ЃОc(OH-) BЃЎc(Cl-)ЃОc(NH4+)ЃОc(OH-)ЃОc(H+)
CЃЎc(Cl-)ЃОc(H+)ЃОc(NH4+)ЃОc(OH-) DЃЎc(NH4+)ЃОc(Cl-)ЃОc(OH-)ЃОc(H+)
ЂйШєШмвКжажЛШмНтСЫвЛжжШмжЪЃЌЩЯЪіРызгХЈЖШДѓаЁЙиЯЕжае§ШЗЕФЪЧЃЈбЁЬюзжФИЃЉ________ЁЃ
ЂкШєЩЯЪіЙиЯЕжаDЪЧе§ШЗЕФЃЌдђШмвКжаЕФШмжЪЮЊ____________________ЃЛ
ЂлШєЯђАБЫЎжаМгШыЯЁСђЫсжСШмвКЕФpH=7ЃЌДЫЪБc(NH4+)=a mol/LЃЌдђc(SO42-)= _____
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўМзУб(CH3OCH3)ЪЧвЛжжаТаЫЛЏЙЄдСЯЃЌОпгаМзЛљЛЏЗДгІадФмЁЃ
l.ЖўМзУбЕФЩњВњЃК
ЖўМзУбЕФЩњВњдРэжЎвЛЪЧРћгУМзДМЭбЫЎГЩЖўМзУбЃЌЛЏбЇЗНГЬЪНШчЯТЃК
ЗДгІi 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ЁїH1
CH3OCH3(g)+H2O(g) ЁїH1
(1)вбжЊЃКМзДМЁЂЖўМзУбЕФЦјЬЌБъзМШМЩеШШЗжБ№ЮЊЃ761.5kJЁЄmolЃ1ЁЂЃ1455.2kJЁЄmolЃ1ЃЌЧвH2O(g)=H2O(1) ЁїH=Ѓ44.0kJЁЄmolЃ1ЁЃ
ЗДгІiЕФЁїH1=___________ kJЁЄmolЃ1ЁЃ
(2)ЗДгІiжаМзДМзЊЛЏТЪЁЂЖўМзУббЁдёадЕФАйЗжТЪгыВЛЭЌДпЛЏМСЕФЙиЯЕШчЭМ1ЫљЪОЃЌЩњВњЪБЃЌбЁдёЕФзюМбДпЛЏМСЪЧ___________ЁЃ


(3)бЁЖЈДпЛЏМСКѓЃЌВтЕУЦНКтЪБЕФМзДМзЊЛЏТЪгыЮТЖШЕФЙиЯЕШчЭМ2ЫљЪОЁЃОбаОПВњЮяЕФЕфаЭЩЋЦзЭМЗЂЯжИУЙ§ГЬжївЊДцдкЕФИБЗДгІЮЊЃК
ЗДгІii 2CH3OH(g)![]() C2H4(g)+2H2O(g) ЁїH2=Ѓ29.1kJЁЄmolЃ1
C2H4(g)+2H2O(g) ЁїH2=Ѓ29.1kJЁЄmolЃ1
ЂйЙЄвЕЩЯЩњВњЖўМзУбЕФЮТЖШЭЈГЃдк270Ѓ300ЁцЃЌИпгк330ЁцжЎКѓЃЌМзДМзЊЛЏТЪЯТНЕЃЌИљОнЛЏбЇЦНКтвЦЖЏдРэЗжЮідвђЪЧ______________________ЃЛИљОнЛЏбЇЗДгІЫйТЪБфЛЏЗжЮідвђЪЧ______________________ЁЃ
ЂкФГЮТЖШЯТЃЌвдCH3OH(g)ЮЊдСЯЃЌЦНКтЪБИїЮяжЪЕФЗжбЙЪ§ОнШчЯТБэЃК

дђЗДгІiжаЃЌCH3OH(g)ЕФЦНКтзЊЛЏТЪІС=___________ЃЌЗДгІiЕФЦНКтГЃЪ§Kp=__________(гУЦНКтЗжбЙДњЬцЦНКтХЈЖШМЦЫуЃЛНсЙћБЃСєСНЮЛгааЇЪ§зж)
Ђђ.ЖўМзУбЕФгІгУЃК
(4)ЭМ3ЮЊТЬЩЋЕчдДЁАжБНгЖўМзУбШМСЯЕчГиЁБЕФЙЄзїдРэЪОвтЭМЃК

ЂйИУЕчГиЕФИКМЋЗДгІЪНЮЊЃК______________________ЃЛ
ЂкШєДЎСЊИУШМСЯЕчГиЕчНтСђЫсФЦШмвКЃЌЯћКФ4.6gЖўМзУбКѓзмЙВПЩдкЕчНтГиСНМЋЪеМЏЕН13.44L(БъПі)ЦјЬхЃЌИУЬззАжУЕФФмСПРћгУТЪЮЊ___________ЁЃ(БЃСє3ЮЛгааЇЪ§зж)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩшNAДњБэАЂЗќйЄЕТТоГЃЪ§ЕФЪ§жЕЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A. 48gO2КЭO3ЕФЛьКЯЦјЬхЫљКЌдзгЪ§ЮЊ3NA
B. БъзМзДПіЯТЃЌ22.4LЕЊЦјКЌгаЕФКЫЭтЕчзгЪ§ЮЊ28NA
C. 5.6gЬњгызуСПЯЁбЮЫсЗДгІзЊвЦЕФЕчзгЪ§ЮЊ0.3NA
D. 20g49%ЕФСђЫсжаЃЌH2SO4ЗжзгЪ§ЮЊ0.1NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМгШШN2O5ЃЌвРДЮЗЂЩњЕФЗжНтЗДгІЮЊЃКЂйN2O5(g)![]() N2O3(g)+O2(g)ЃЌЂкN2O3(g)
N2O3(g)+O2(g)ЃЌЂкN2O3(g)![]() N2O(g)+O2(g)ЁЃдкШнЛ§ЮЊ2LЕФУмБеШнЦїжаГфШы8mol N2O5ЃЌМгШШЕНtЁцЃЌДяЕНЦНКтзДЬЌКѓO2ЮЊ9molЃЌN2O3ЮЊ3.4molЃЌдђtЁцЪБЗДгІЂйЕФЦНКтГЃЪ§ЮЊЃЈ ЃЉ
N2O(g)+O2(g)ЁЃдкШнЛ§ЮЊ2LЕФУмБеШнЦїжаГфШы8mol N2O5ЃЌМгШШЕНtЁцЃЌДяЕНЦНКтзДЬЌКѓO2ЮЊ9molЃЌN2O3ЮЊ3.4molЃЌдђtЁцЪБЗДгІЂйЕФЦНКтГЃЪ§ЮЊЃЈ ЃЉ
A. 4.25 B. 8.5 C. 17 D. 22.5
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПАДвЊЧѓЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉ0.3molNH3жаЫљКЌжЪзгЪ§гы______gH2OЗжзгжаЫљКЌжЪзгЪ§ЯрЕШЁЃ
ЃЈ2ЃЉгы3.2gSO2ЫљКЌЕФбѕдзгЪ§ЯрЕШЕФNO2ЦјЬхдкБъзМзДПіЯТЕФЬхЛ§ЮЊ_______LЁЃ
ЃЈ3ЃЉНЋ30ml 0.5mol/LЕФNaOHШмвКМгЫЎЯЁЪЭЕН500mlЃЌЯЁЪЭКѓШмвКЮяжЪЕФСПХЈЖШЮЊ_______ЁЃ
ЃЈ4ЃЉЭЌЮТЭЌбЙЯТЃЌSO2гыO2ЕФУмЖШБШЮЊ____ЃЌШєжЪСПЯрЭЌЃЌСНжжЦјЬхЬхЛ§БШЮЊ___ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКуШнУмБеШнЦїжаЃЌНЋ10 mol COКЭвЛЖЈСПЕФH2SЛьКЯМгШШВЂДяЕНЯТСаЦНКтЃКCO(g)ЃЋH2S(g) ![]() COS(g)ЃЋH2(g) KЃН1ЃЌЦНКтКѓCOЮяжЪЕФСПЮЊ8 molЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
COS(g)ЃЋH2(g) KЃН1ЃЌЦНКтКѓCOЮяжЪЕФСПЮЊ8 molЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. COЃЎH2SЕФзЊЛЏТЪжЎБШЮЊ1:1
B. ДяЦНКтКѓH2SЕФЬхЛ§ЗжЪ§ЮЊ4%
C. Щ§ИпЮТЖШЃЌCOSХЈЖШМѕаЁЃЌБэУїИУЗДгІЪЧЮќШШЗДгІ
D. КуЮТЯТЯђЦНКтЬхЯЕжадйМгШыCOЃЎH2SЃЎCOSЃЎH2Иї1 molЃЌЦНКтВЛвЦЖЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУЭКЭХЈСђЫсжЦБИSO2ЕФЗНГЬЪНЮЊЃКCu+2H2SO4(ХЈЃЉ![]() CuSO4+SO2Ёќ+2H2OЃЌЯжгУ3.2gCuгывЛЖЈСПЕФХЈСђЫсЗДгІжЦSO2ЦјЬхЃЌЭЭъШЋШмНтЁЃЧыМЦЫуЃК
CuSO4+SO2Ёќ+2H2OЃЌЯжгУ3.2gCuгывЛЖЈСПЕФХЈСђЫсЗДгІжЦSO2ЦјЬхЃЌЭЭъШЋШмНтЁЃЧыМЦЫуЃК
ЃЈ1ЃЉЧѓБъзМзДПіЯТВњЩњSO2ЬхЛ§ЮЊЖрЩй______ LЃП
ЃЈ2ЃЉШєНЋЗДгІКѓЕФШмвКМгЫЎЯЁЪЭжС500mLЃЌЧѓЗДгІКѓCuSO4ШмвКЕФХЈЖШЮЊЖрЩй______ molЁЄLЃ1ЃП
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com