
【题目】按要求回答下列问题:
(1)0.3molNH3中所含质子数与______gH2O分子中所含质子数相等。
(2)与3.2gSO2所含的氧原子数相等的NO2气体在标准状况下的体积为_______L。
(3)将30ml 0.5mol/L的NaOH溶液加水稀释到500ml,稀释后溶液物质的量浓度为_______。
(4)同温同压下,SO2与O2的密度比为____,若质量相同,两种气体体积比为___ 。
【答案】5.4g 1.12L 0.03mol/L 2:1 1:2
【解析】
(1)依据n = ![]() =
= ![]() ,结合分子与原子构成解答;
,结合分子与原子构成解答;
(2)依据n = ![]() =
= ![]() =
= ![]() ,结合分子与原子构成解答;
,结合分子与原子构成解答;
(3)根据稀释定律可知,溶液稀释前后溶质的物质的量不变,据此计算;
(4)同温同压下,气体密度之比等于摩尔质量之比,结合n= ![]() =
= ![]() =
= ![]() 、气体的密度ρ =
、气体的密度ρ = ![]() 进行计算。
进行计算。
(1)0.3 mol NH3含有的质子数的物质的量为0.3mol×(7+3)=3 mol,而1 mol H2O含有质子数为(2×1+8) mol=10mol,则应有0.3 mol H2O,其质量为m(H2O)=0.3 mol×18 g/mol=5.4 g;
故答案为:5.4 g;
(2)3.2 g SO2的物质的量为![]() = 0.05 mol,则分子内所含的氧原子数为0.05 mol×2×NA = 0.1NA,则对应相等氧原子数的NO2气体的物质的量 = 0.05 mol,在标准状况下的体积 = 0.05 mol×22.4 L/mol = 1.12 L,
= 0.05 mol,则分子内所含的氧原子数为0.05 mol×2×NA = 0.1NA,则对应相等氧原子数的NO2气体的物质的量 = 0.05 mol,在标准状况下的体积 = 0.05 mol×22.4 L/mol = 1.12 L,
故答案为:1.12L;
(3)令稀释后溶液中NaOH的物质量浓度为c,则:
30×10﹣3 L×0.5 mol/L=500×10﹣3 L×c
解得 c = 0.03 mol/L,
故答案为:0.03 mol/L;
(4)根据ρ = ![]() 知,同温同压下,气体密度之比等于摩尔质量之比,所以二者密度之比 = 64 g/mol:32 g/mol = 2:1;
知,同温同压下,气体密度之比等于摩尔质量之比,所以二者密度之比 = 64 g/mol:32 g/mol = 2:1;
根据n= ![]() =
= ![]() =
= ![]() 可知:相同条件下,质量相等的气体,V与M成反比,所以若质量相同,两种气体的体积比为32 g/mol: 64 g/mol = 1:2;
可知:相同条件下,质量相等的气体,V与M成反比,所以若质量相同,两种气体的体积比为32 g/mol: 64 g/mol = 1:2;
故答案为:2:1;1:2。


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 ,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )
A. 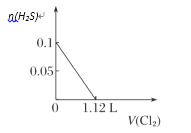 B.
B. 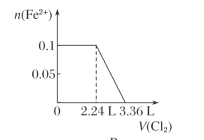
C. 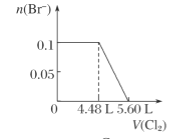 D.
D. 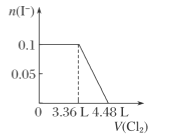
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置及其使用的叙述中,正确的是(部分装置未画出)( )
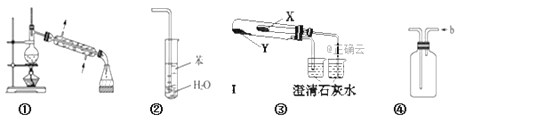
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3,并防止倒吸
C. 利用装置③验证KHCO3和K2CO3的热稳定性,X中应放的物质是KHCO3
D. 装置④ b口进气可收集Cl2、NO等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与其浓度和反应温度有关。下列各组物质反应产物与其浓度有关的是( )
①Cu与HNO3溶液 ②Na与O2 ③Zn与H2SO4溶液 ④Fe与盐酸
A. ①③ B. ③④ C. ①② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、C12、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
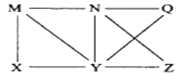
A. N一定是HCl(aq) B. X可能为Al或C12
C. Y一定为NaOH(aq) D. Q、Z中的一种必定为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)与CO互为等电子体的分子和离子分别为______和______。
(2)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
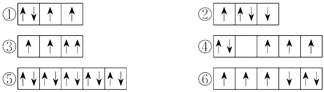
(3)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
![]()
已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有_________________。
②写出氧化过程中的离子方程式:________。
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是__________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是______(填选项序号)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定________和__________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作(按操作先后顺序列出) ______________(填序号)。
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学化学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是
( )。
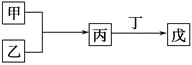
A. 若组成甲、乙的元素位于同一周期,则戊可能是一种弱酸
B. 若组成甲、乙的元素位于同一主族,则戊可能是一种弱酸
C. 若甲为短周期中原子半径最大的主族元素形成的单质,且戊为碱,则丙只能为Na2O2
D. 若丙、丁混合生成白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com