
【题目】向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 ,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )
A. 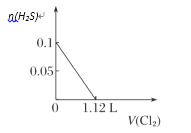 B.
B. 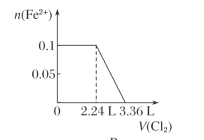
C. 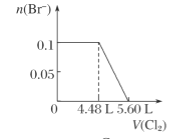 D.
D. 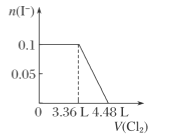
【答案】C
【解析】
微粒还原性H2S>I->Fe2+>Br-,故首先发生反应S2-+Cl2=S+2Cl-,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断。
微粒还原性H2S>I->Fe2+>Br-,故首先发生反应S2-+Cl2=S+2Cl-,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,0.1molH2S完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05氯气,0.1molFe2+完全反应消耗0.05氯气,0.1molBr-完全反应消耗0.05氯气。A.由H2S+Cl2=S↓+2H++2Cl-可知,0.1molH2S完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,选项A错误;B.0.1molH2S完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为0.15mol×22.4L/mol=3.36L,由2Fe2++Cl2=2Fe3++2Cl-可知,0.1molFe2+完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,图象与实际不符合,选项B错误;C.H2S、I-、Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,即溴离子开始反应时氯气的体积为4.48L,由2Br-+Cl2=2Br2+2Cl-可知,0.1molBr-完全反应消耗0.05氯气,故溴离子完全反应时消耗氯气的体积为4.48L+0.05mol×22.4L/mol=5.6L,图象中氯气的体积符合,选项C正确;D.0.1molH2S完全反应后,才发生2I-+Cl2=I2+2Cl-,0.1molH2S完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1molI-完全反应消耗0.05氯气,故0.1molI-完全反应时氯气的体积为0.15mol×22.4L/mol=3.36L,图象中氯气的体积不符合,选项D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A. 该固体中一定含有NH4+、CO32-、SO42-、Na+ B. 该固体中一定没有Cu2+、Cl-、Na+
C. 该固体中只含有NH4+、CO32-、SO42-、Cl- D. 根据以上实验,无法确定该固体中有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置反映了元素的原子结构和性质。请回答下列有关硼(B)元素的问题:
(1)![]() 原子核内的中子数为________。
原子核内的中子数为________。
(2)硼元素在元素周期表中的位置为___________。
(3)![]() 的原子半径__________
的原子半径__________![]() 的原子半径(填“大于”或“小于”)。
的原子半径(填“大于”或“小于”)。
(4)硼元素的最高价氧化物对应的水化物酸性比氮元素的最高价氧化物对应的水化物酸性_______(填“强”或“弱”)。
(5)四氢硼锂(LiBH4)是一种重要的化学试剂,低温下可与HCl气体发生如下反应:2 LiBH4 + 2 HCl = 2 LiCl + B2H6 + 2H2该反应中,LiBH4和B2H6中的氢元素均显-1价。请回答下列问题。LiBH4中硼元素的化合价为__________;该反应的还原剂为____________;4 mol LiBH4完全反应后共失去_____mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
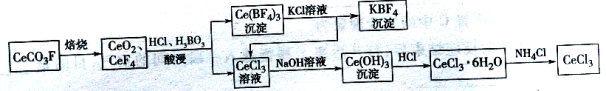
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为 。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式: 。
(3)向Ce(BF4)3中加入KCl溶液的目的是 。
(4)溶液中的C(Ce3+)等于1×10-5mol.l-1,可认为Ce3+沉淀完全,此时溶液的PH为 。(已知KSP[Ce(OH)3]=1×10-20)
(5)加热CeCl3 .6H2O和NH4Cl的固体混合物可得到无水CeCl3 ,其中NH4Cl的作用是 。
(6)准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后用0.1000mol.l-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00ml标准溶液。(已知:Fe2++Ce4+=
Ce3++Fe3+)
①该样品中CeCl3的质量分数为 。
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数 (填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果与图像不相符的是
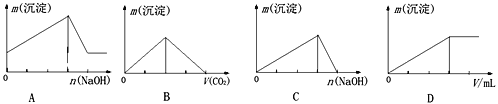
A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中能产生气体,但不是氧化还原反应的是( )
A. 浓盐酸与二氧化锰共热 B. 稀硫酸与硫化亚铁固体反应
C. 硝酸银与稀盐酸反应 D. 过氧化钠与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)0.3molNH3中所含质子数与______gH2O分子中所含质子数相等。
(2)与3.2gSO2所含的氧原子数相等的NO2气体在标准状况下的体积为_______L。
(3)将30ml 0.5mol/L的NaOH溶液加水稀释到500ml,稀释后溶液物质的量浓度为_______。
(4)同温同压下,SO2与O2的密度比为____,若质量相同,两种气体体积比为___ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com