
【题目】下列反应中能产生气体,但不是氧化还原反应的是( )
A. 浓盐酸与二氧化锰共热 B. 稀硫酸与硫化亚铁固体反应
C. 硝酸银与稀盐酸反应 D. 过氧化钠与水反应
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应中,与“ 雷雨发庄稼” 无关的是
A.N2+3H2![]() 2NH3
2NH3
B.N2+O2![]() 2NO
2NO
C.2NO+O2=2NO2
D.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 ,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )
A. 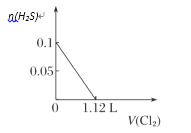 B.
B. 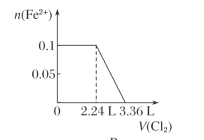
C. 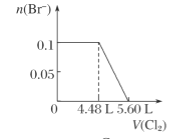 D.
D. 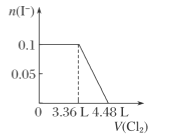
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7),其主要反应为
①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
A. 反应①和②均为氧化还原反应
B. 反应①,转移4 mol电子时,被氧化的为O2为1mol
C. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
D. 生成1 mol Na2Cr2O7时共转移5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法中正确的是( )
A.自然界中硅元素的含量最丰富B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片D.光导纤维的主要成分是硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢化钙是固体登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙.
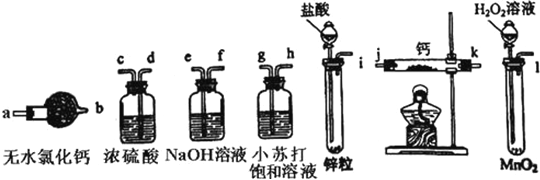
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为__________(填仪器接口的字母编号)
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞_________(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(3)已知钙与氢化钙固体在外观上相似,现设计一个实验,用化学方法区分钙与氢化钙,请完善以下实验的简要步骤及观察到的现象:取适量氢化钙,在加热条件下与________反应,将反应气相产物通过装有_______的容器,观察到容器内固体颜色变化为________;取钙做类似实验,观察不到类似的反应现象.
II.某化学兴趣小组发现,往CuSO4溶液中加入一定浓度的Na2CO3溶液得到的蓝色沉淀,若加入NaOH溶液则得到浅绿色沉淀。为此,小组同学对蓝色沉淀成份作了如下探究:
该小组同学利用下列装置通过实验测定其组成
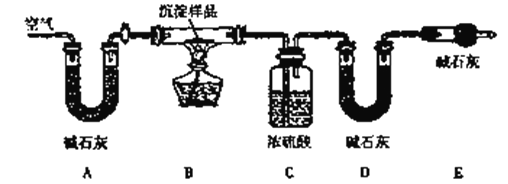
(1)检查装置气密性并装好药品后,点燃酒精灯前应进行的操作是______________。
(2)通过查找资料得知,该浅绿色沉淀物可能是溶解度最小的碱式硫酸铜(化学式CuSO4·3Cu(OH)2)。请你设计一个实验,证明浊液中的浅绿色沉淀物中是否含有硫酸根离子的方法__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置及其使用的叙述中,正确的是(部分装置未画出)( )
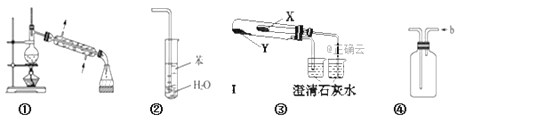
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3,并防止倒吸
C. 利用装置③验证KHCO3和K2CO3的热稳定性,X中应放的物质是KHCO3
D. 装置④ b口进气可收集Cl2、NO等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与其浓度和反应温度有关。下列各组物质反应产物与其浓度有关的是( )
①Cu与HNO3溶液 ②Na与O2 ③Zn与H2SO4溶液 ④Fe与盐酸
A. ①③ B. ③④ C. ①② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁是一种新型高效的无机高分子絮凝剂。用硫酸亚铁晶体及硫酸为原料催化氧化法生成硫酸铁,再水解、聚合成产品。实验室模拟生产过程如下:
![]()
已知Fe3+能水解成氢氧化铁:Fe3++3H2O===Fe(OH)3+3H+,为了防止Fe3+水解需加入硫酸。
(1)①用原料配制2.50 moL·L-1的硫酸亚铁溶液时用到的定量仪器有_________________。
②写出氧化过程中的离子方程式:________。
(2)综合考虑实际投料硫酸亚铁与硫酸的物质的量之比为1/1.25左右最佳,加入的硫酸比理论值稍多,但不能过多的原因是__________________________________。
(3)硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3·ySO3·zH2O),现采用重量法测定x、y、z的值。
①测定时所需的试剂是______(填选项序号)。
A.NaOH B. Ba(OH)2
C.BaCl2D.FeSO4
②需要测定________和__________的质量(填写化合物的化学式)。
(4)选出测定过程中所需的基本操作(按操作先后顺序列出) ______________(填序号)。
①过滤、洗涤 ②蒸发、结晶 ③萃取、分液 ④冷却、称量 ⑤烘干或灼烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com