
【题目】下列关于各实验装置及其使用的叙述中,正确的是(部分装置未画出)( )
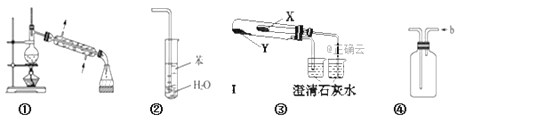
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3,并防止倒吸
C. 利用装置③验证KHCO3和K2CO3的热稳定性,X中应放的物质是KHCO3
D. 装置④ b口进气可收集Cl2、NO等气体
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验结果与图像不相符的是
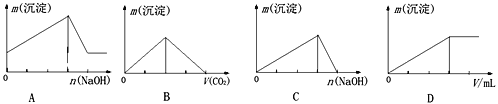
A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中能产生气体,但不是氧化还原反应的是( )
A. 浓盐酸与二氧化锰共热 B. 稀硫酸与硫化亚铁固体反应
C. 硝酸银与稀盐酸反应 D. 过氧化钠与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D 原子序数依次增大且最外层电子数之和为17。B、D 同主族,短周期中C原子半径最大,B最外层电子数是次外层的3倍。下列推断不正确的是
A. 元素B、C、D 形成的化合物的水溶液呈中性
B. 元素B、C 形成的化合物中可能既含有离子键又含共价键
C. 离子半径从大到小的顺序为D>B>C
D. 元素B 的简单气态氢化物的热稳定性比D 的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )
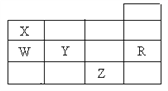
A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是__________
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
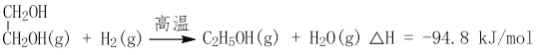
获取乙二醇的反应历程可分为如下2步:
I. 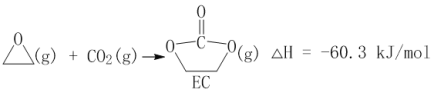
II.EC加氢能生成乙二醇与甲醇。
①步骤II的热化学方程式是__________;
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/℃ | EC转化率/ % | 产率/% | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是__________。温度升高到220℃时,乙二醇的产率反而降低,原因是__________
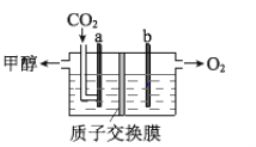
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极 a 接电源的__________极(填“正”或“负”),生成甲醇的电极反应式是__________
(4)CO2较稳定、能量低。为实现CO2的高效使用,下列研究方向合理的是__________(填序号)。
a.降低CO2参与反应的速率和比例
b.利用电能、光能或热能预先活化CO2分子
c.选择高效的催化剂降低反应条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)0.3molNH3中所含质子数与______gH2O分子中所含质子数相等。
(2)与3.2gSO2所含的氧原子数相等的NO2气体在标准状况下的体积为_______L。
(3)将30ml 0.5mol/L的NaOH溶液加水稀释到500ml,稀释后溶液物质的量浓度为_______。
(4)同温同压下,SO2与O2的密度比为____,若质量相同,两种气体体积比为___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:

(1)请写出一种能提高“酸浸”速率的措施:___________________________________;滤渣I的成分是CaSO4和____________________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:

①若控制温度40℃、pH=8,则滤渣II的主要成分为___________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀(图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_______mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com