
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是__________
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
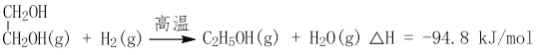
获取乙二醇的反应历程可分为如下2步:
I. 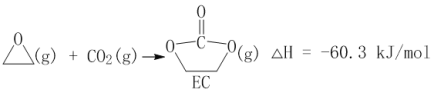
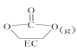
II.EC加氢能生成乙二醇与甲醇。
①步骤II的热化学方程式是__________;
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/℃ | EC转化率/ % | 产率/% | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是__________。温度升高到220℃时,乙二醇的产率反而降低,原因是__________
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极 a 接电源的__________极(填“正”或“负”),生成甲醇的电极反应式是__________
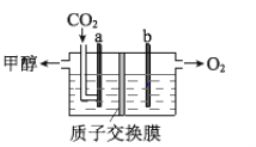
(4)CO2较稳定、能量低。为实现CO2的高效使用,下列研究方向合理的是__________(填序号)。
a.降低CO2参与反应的速率和比例
b.利用电能、光能或热能预先活化CO2分子
c.选择高效的催化剂降低反应条件
【答案】![]()
 +3H2(g)=
+3H2(g)= ![]() +CH3OH(g)
+CH3OH(g) ![]() 温度越高,反应速率越快;反应温度过高,乙二醇会深度加氢生成乙醇,乙二醇的产率降低;负 CO2+6H++6e-=CH3OH+H2O bc
温度越高,反应速率越快;反应温度过高,乙二醇会深度加氢生成乙醇,乙二醇的产率降低;负 CO2+6H++6e-=CH3OH+H2O bc
【解析】
(1)CO2中存在2个碳氧双键;(2)①根据盖斯定律书写EC加氢生成乙二醇与甲醇的热化学方程式;②温度越高,反应速率越快;温度升高到220℃时,乙二醇会深度加氢生成乙醇;(3)a电极CO2→CH3OH发生还原反应,a是阴极;(4)a.实现CO2的高效使用,应升高CO2参与反应的速率和比例;预先活化CO2分子,可以提高反应速率;高效的催化剂能加快反应速率;
(1)CO2中存在2个碳氧双键,电子式是![]() ;(2)①a:
;(2)①a:![]() ;b:
;b: 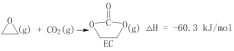 。根据盖斯定律,a-b得:
。根据盖斯定律,a-b得: 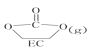 +3H2(g)=
+3H2(g)= ![]() +CH3OH(g)
+CH3OH(g) ![]() ;②温度越高,反应速率越快,所以温度越高,EC的转化率越高;温度升高到220℃时,乙二醇会深度加氢生成乙醇,所以温度升高到220℃时,乙二醇的产率反而降低;(3)a电极CO2→CH3OH发生还原反应,a是阴极,连接电源负极;阴极反应式是CO2+6H++6e-=CH3OH+H2O;(4)a.实现CO2的高效使用,应升高CO2参与反应的速率和比例,故a错误;预先活化CO2分子,可以提高反应速率,故b正确;高效的催化剂能加快反应速率,故c正确。
;②温度越高,反应速率越快,所以温度越高,EC的转化率越高;温度升高到220℃时,乙二醇会深度加氢生成乙醇,所以温度升高到220℃时,乙二醇的产率反而降低;(3)a电极CO2→CH3OH发生还原反应,a是阴极,连接电源负极;阴极反应式是CO2+6H++6e-=CH3OH+H2O;(4)a.实现CO2的高效使用,应升高CO2参与反应的速率和比例,故a错误;预先活化CO2分子,可以提高反应速率,故b正确;高效的催化剂能加快反应速率,故c正确。


科目:高中化学 来源: 题型:
【题目】有下列几种反应类型:①消去 ②取代 ③水解 ④加成 ⑤还原 ⑥氧化,用丙醛制取1,2-丙二醇 ( ),按正确的合成路线依次发生的反应所属类型不可能是( )
),按正确的合成路线依次发生的反应所属类型不可能是( )
A. ⑤⑥③① B. ⑤①④③ C. ⑤①④② D. ④①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法中正确的是( )
A.自然界中硅元素的含量最丰富B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片D.光导纤维的主要成分是硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各实验装置及其使用的叙述中,正确的是(部分装置未画出)( )
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3,并防止倒吸
C. 利用装置③验证KHCO3和K2CO3的热稳定性,X中应放的物质是KHCO3
D. 装置④ b口进气可收集Cl2、NO等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式_________________。
(2)A、B、C三种元素的第一电离能由大到小的顺序为______________(用元素符号表示),原因是___________________。
(3)已知DC4常温下为气体,则该物质的晶体类型是_________,组成微粒的中心原子的轨道杂化类型为____________,空间构型是___________。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是______________________。
(5)A、B两元素分别与D形成的共价键中,极性较强的是__________。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为__________。
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为__________,一个E的晶胞质量为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与其浓度和反应温度有关。下列各组物质反应产物与其浓度有关的是( )
①Cu与HNO3溶液 ②Na与O2 ③Zn与H2SO4溶液 ④Fe与盐酸
A. ①③ B. ③④ C. ①② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)与CO互为等电子体的分子和离子分别为______和______。
(2)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
(3)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去)。下列说法不正确的是:
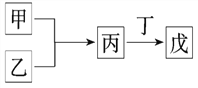
A. 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B. 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
C. 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
D. 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com