
【题目】(1)与CO互为等电子体的分子和离子分别为______和______。
(2)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。
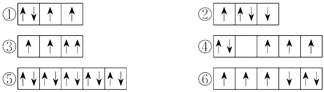
(3)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
【答案】 N2 C22- 或 CN- ③ ②④⑥ 1s22s22p63s23p4 H2SO4 ①④⑥③②⑤
【解析】分析:(1)原子数和价电子数分别都相等的互为等电子体;
(2)泡利原理是指在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋方向相反。洪特规则是指当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据1个轨道,并且自旋方向相同。
(3)根据激发态原子核外电子排布式知该元素核外有16个电子,根据能量最低原理分析其基态原子核外电子排;
(4)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……。
详解:(1)原子数和价电子数分别都相等的互为等电子体,则与CO互为等电子体的分子和离子分别为N2、C22-或CN-。
(2)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,称为泡利不相容原理,所以违反泡利不相容原理的有③;当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,所以违反洪特规则的有②④⑥;
(3)根据激发态原子核外电子排布式知该元素核外有16个电子,为S元素;根据能量最低原理,其基态原子核外电子排是1s22s22p63s23p4;S元素最外层有6个电子,所以最高价是+6价,最高价氧化物对应水化物的化学式是H2SO4;
(4)相同电子层上原子轨道能量的高低:ns<np<nd;形状相同的原子轨道能量的高低:1s<2s<3s<4s……,因此多电子原子的原子轨道按轨道能量由低到高顺序是①④⑥③②⑤。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验结果与图像不相符的是
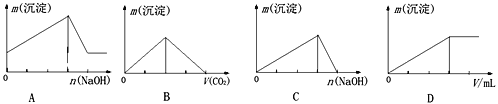
A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是__________
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
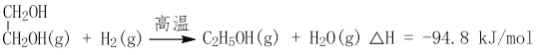
获取乙二醇的反应历程可分为如下2步:
I. 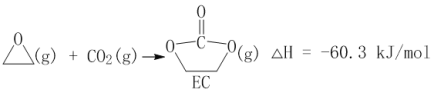
II.EC加氢能生成乙二醇与甲醇。
①步骤II的热化学方程式是__________;
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/℃ | EC转化率/ % | 产率/% | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是__________。温度升高到220℃时,乙二醇的产率反而降低,原因是__________
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极 a 接电源的__________极(填“正”或“负”),生成甲醇的电极反应式是__________
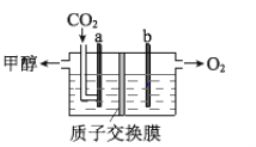
(4)CO2较稳定、能量低。为实现CO2的高效使用,下列研究方向合理的是__________(填序号)。
a.降低CO2参与反应的速率和比例
b.利用电能、光能或热能预先活化CO2分子
c.选择高效的催化剂降低反应条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)0.3molNH3中所含质子数与______gH2O分子中所含质子数相等。
(2)与3.2gSO2所含的氧原子数相等的NO2气体在标准状况下的体积为_______L。
(3)将30ml 0.5mol/L的NaOH溶液加水稀释到500ml,稀释后溶液物质的量浓度为_______。
(4)同温同压下,SO2与O2的密度比为____,若质量相同,两种气体体积比为___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存的一组离子是( )
A. K+、H+、SO32-、S2- B. NH4+、K+、OH-、Cl-
C. H+、K+、MnO4-、SO42- D. Fe3+、Na+、S2-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是( )
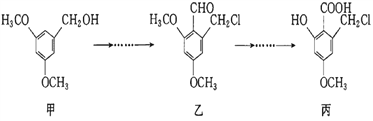
A. 乙、丙都能发生银镜反应
B. 可用FeCl3溶液鉴别甲、丙两种有机化合物
C. 甲分子中所有碳原子可能共平面
D. 乙、丙两种有机化合物均可与NaOH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入或加入另一种物质仍无沉淀产生,则通入或加入的物质不可能是( )
A. 氨水 B. CO2 C. 过氧化氢溶液 D. SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:

(1)请写出一种能提高“酸浸”速率的措施:___________________________________;滤渣I的成分是CaSO4和____________________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:

①若控制温度40℃、pH=8,则滤渣II的主要成分为___________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀(图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_______mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有过氧化物存在的条件下,不对称烯烃与HBr加成的反应规律是溴原子加在含氢较多的碳原子上,如: CH3—CH=CH2 + HBr![]() CH3CH2CH2Br。现有分子式为C8H13O2Cl的酯A,在一定条件下发生如下图所示的一系列变化:
CH3CH2CH2Br。现有分子式为C8H13O2Cl的酯A,在一定条件下发生如下图所示的一系列变化:
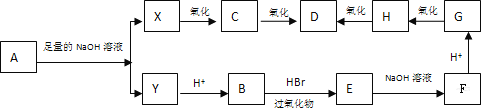
已知:A分子中不含甲基,试回答下列问题:
(1)写出下列物质的结构简式:Y____________、D___________。
(2)写出下列反应的化学方程式:
①A和足量NaOH溶液共热________________________________________;
②B→E ______________________________________________________________;
③X→C ______________________________________________________________;
④X与D发生缩聚反应:_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com