
【题目】有下列几种反应类型:①消去 ②取代 ③水解 ④加成 ⑤还原 ⑥氧化,用丙醛制取1,2-丙二醇 ( ),按正确的合成路线依次发生的反应所属类型不可能是( )
),按正确的合成路线依次发生的反应所属类型不可能是( )
A. ⑤⑥③① B. ⑤①④③ C. ⑤①④② D. ④①④②
【答案】A
【解析】分析:用丙醛制取1,2-丙二醇,可先用丙醛与氢气发生加成反应生成丙醇,丙醇发生消去反应生成丙烯,然后丙烯与溴水加成生成1,2-二溴丙烷,最后1,2-二溴丙烷水解即可得到1,2-丙二醇。
详解:用丙醛制取1,2-丙二醇,其合成路线为:先用丙醛与氢气加成生成丙醇,该反应为④加成反应,也属于⑤还原反应,再由丙醇发生消去反应生成丙烯,为①消去反应,然后丙烯与溴水加成生成1,2-二溴丙烷,为④加成反应,最后1,2-二溴丙烷水解生成1,2-丙二醇,为③水解反应,也属于②取代反应,则合成中涉及的反应为⑤①④③或⑤①④②或④①④②,该合成路线中没有涉及氧化反应,不可能为⑤⑥③①,故答案选A。


科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活中占有极其重要的地位,请结合金属及其化合物的相关知识回答下列问题.
(1)含碳量在0.03%~2%之间某合金,是目前使用量最大的合金,这种合金是____。
A.铝合金 B.青铜 C.镁合金 D.钢
(2)FeCl3溶液用于腐蚀铜箔印刷线路板,反应的离子方程式为__________。
(3)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入足量的Na2O2后,过滤,将滤渣投入足量的盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 (填字母)
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(4)Fe(NO3)3的高纯度结晶体是一种紫色潮解性固体,适合于制磁性氧化铁纳米粉末,工业上用废铁屑(含Fe和Fe2O3及其它不反应的物质)制取Fe(NO3)3晶体的方法如下:
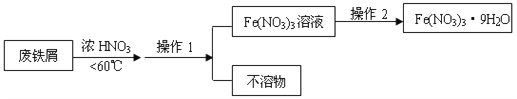
①第1步反应若温度过高,将导致硝酸分解,浓硝酸受热分解的化学方程式为_______________。
②磁性氧化铁的化学式为______,试写出Fe2O3与硝酸反应的离子方程式_________________。
③操作1的名称为_____,操作2的步骤为:_____________,过滤,洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图所示装置检验草酸亚铁晶体(FeC2O4·2H2O,淡黄色)受热分解的部分产物。下列说法正确的是( )
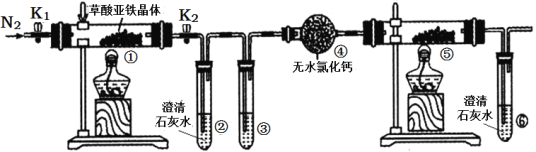
A. 通入N2的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若③和⑤中分别盛放足量NaOH溶液、CuO固体,可检验生成的CO
C. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
D. 若将④中的无水CaC12换成无水硫酸铜可检验分解生成的水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化学工业的发展,各种化学合成材料已走进我们寻常百姓家,下列关于生活中常用材料的认识正确的是( )
A. 尼龙、羊毛和棉花都是天然纤维
B. 有机玻璃、锦纶、电玉、真丝巾都是合成塑料
C. 天然橡胶的化学组成是聚异戊二烯
D. 装食品用的聚乙烯塑料可以通过加热进行封口
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素在周期表中的位置反映了元素的原子结构和性质。请回答下列有关硼(B)元素的问题:
(1)![]() 原子核内的中子数为________。
原子核内的中子数为________。
(2)硼元素在元素周期表中的位置为___________。
(3)![]() 的原子半径__________
的原子半径__________![]() 的原子半径(填“大于”或“小于”)。
的原子半径(填“大于”或“小于”)。
(4)硼元素的最高价氧化物对应的水化物酸性比氮元素的最高价氧化物对应的水化物酸性_______(填“强”或“弱”)。
(5)四氢硼锂(LiBH4)是一种重要的化学试剂,低温下可与HCl气体发生如下反应:2 LiBH4 + 2 HCl = 2 LiCl + B2H6 + 2H2该反应中,LiBH4和B2H6中的氢元素均显-1价。请回答下列问题。LiBH4中硼元素的化合价为__________;该反应的还原剂为____________;4 mol LiBH4完全反应后共失去_____mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果与图像不相符的是
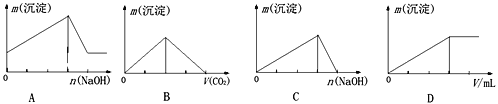
A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是__________
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
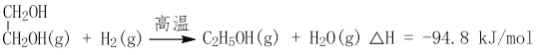
获取乙二醇的反应历程可分为如下2步:
I. 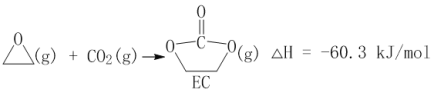
II.EC加氢能生成乙二醇与甲醇。
①步骤II的热化学方程式是__________;
②研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/℃ | EC转化率/ % | 产率/% | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是__________。温度升高到220℃时,乙二醇的产率反而降低,原因是__________
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极 a 接电源的__________极(填“正”或“负”),生成甲醇的电极反应式是__________
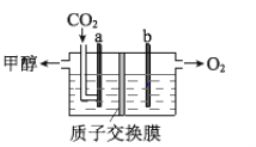
(4)CO2较稳定、能量低。为实现CO2的高效使用,下列研究方向合理的是__________(填序号)。
a.降低CO2参与反应的速率和比例
b.利用电能、光能或热能预先活化CO2分子
c.选择高效的催化剂降低反应条件
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com