
【题目】元素在周期表中的位置反映了元素的原子结构和性质。请回答下列有关硼(B)元素的问题:
(1)![]() 原子核内的中子数为________。
原子核内的中子数为________。
(2)硼元素在元素周期表中的位置为___________。
(3)![]() 的原子半径__________
的原子半径__________![]() 的原子半径(填“大于”或“小于”)。
的原子半径(填“大于”或“小于”)。
(4)硼元素的最高价氧化物对应的水化物酸性比氮元素的最高价氧化物对应的水化物酸性_______(填“强”或“弱”)。
(5)四氢硼锂(LiBH4)是一种重要的化学试剂,低温下可与HCl气体发生如下反应:2 LiBH4 + 2 HCl = 2 LiCl + B2H6 + 2H2该反应中,LiBH4和B2H6中的氢元素均显-1价。请回答下列问题。LiBH4中硼元素的化合价为__________;该反应的还原剂为____________;4 mol LiBH4完全反应后共失去_____mol电子。
【答案】6 第二周期第IIIA族 大于 弱 +3 LiBH4 4
【解析】
(1)中子数等于质量数减去质子数;
(2)根据电子层数=周期数、主族序数=最外层电子数,分析解答;
(3)同周期从左到右半径逐渐减小;
(4)非金属性越强,最高价氧化物对应水化物的酸性越强。
(5)根据化合价代数和为0;反应2 LiBH4+2 HCl=2 LiCl+B2H6+2H2,HCl中H元素化合价降低,LiBH4中的部分氢元素化合价升高,结合氧化还原反应的规律分析解答。
(1)115B的质量数为11,质子数为5,原子核内的中子数为11-5=6,故答案为:6;
(2)电子层数=周期数;主族序数=最外层电子数,硼元素两个电子层,最外层3个电子,因此硼元素在元素周期表中位于第二周期第ⅢA族,故答案为:第二周期第ⅢA族;
(3)同周期从左到右半径逐渐减小,所以115B的原子半径比147N的原子半径大,故答案为:大于;
(4)非金属性越强,最高价氧化物对应水化物的酸性越强,氮的非金属性强于硼,所以硼元素的最高价氧化物对应的水化物酸性比氮元素的最高价氧化物对应的水化物酸性弱,故答案为:弱。
(5)因为LiBH4和B2H6中的氢元素均显-1价,而Li是+1价,所以LiBH4中硼元素的化合价为+3价;反应2 LiBH4+2 HCl=2 LiCl+B2H6+2H2,HCl中H元素化合价降低,氯化氢是氧化剂,LiBH4中的部分氢元素失电子是还原剂,由反应可知2mol LiBH4完全反应转移2mol的电子,所以4 mol LiBH4完全反应后共失去4mol的电子,故答案为:+3;故答案为:LiBH4;4。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的水解反应和氢解反应是两种常用的脱硫方法:
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H=-34kJ/mol
H2S(g)+CO2(g) △H=-34kJ/mol
氢解反应:COS(g)+H2(g) ![]() H2S(g)+CO(g) △H=+7kJ/mol。
H2S(g)+CO(g) △H=+7kJ/mol。
已知:2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol。
写出表示CO燃烧热的热化学方程式:______________。
(2)氢解反应达到平衡后,保持体系的温度和总压强不变,通入适量的He,正反应速率____(填“增大”“减小”或“不变”,下同),COS的转化率_______。
(3)某温度下,向体积为2L的恒容密闭容器中通入2molCOS(g)和4molH2O(g),发生水解反应,5min后反应达到平衡,测得COS(g)的转化率为75%。
回答下列问题:
①反应从起始至5min内,v(H2S)=_______mol·L-1·min-1。
②该温度下,上述水解反应的平衡常数K=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用如下图装置制备氢氧化亚铁并观察其颜色。

提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
(1)稀硫酸应放在_____________中(填写仪器名称)。
(2)本实验通过控制A、B、C三个开关,可将仪器中的空气排尽,具体操作为:关闭开关_______,打开开关________,打开分液漏斗活塞;待反应一段时间排尽空气后,再关闭开关_______,打开开关_______,就可观察到氢氧化亚铁的颜色。试分析实验开始时需排尽装置中空气的理由_______________________________(用化学反应方程式作答)。
(3)某同学认为本实验中应该用铁钉代替铁粉,他的理由是________________________。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①从摩尔盐水溶液中提取 (NH4)2SO4·FeSO4·6H2O晶体的具体操作是______________,用乙醇洗涤,干燥。
②为了测定产品的纯度,称取10 g产品溶于50 mL水中,配制成250 mL溶液,用浓度为0.01 mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00 mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
通过实验数据计算的该产品纯度为________,上表中第一次实验中记录数据明显大于后两次,其原因可能是________。
A.第一次滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.第一次实验结束时俯视刻度线读取酸性高锰酸钾溶液的体积
C.第一次滴定用的锥形瓶用待测液润洗过
D.第一次实验装高锰酸钾的滴定管清洗后没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种反应类型:①消去 ②取代 ③水解 ④加成 ⑤还原 ⑥氧化,用丙醛制取1,2-丙二醇 ( ),按正确的合成路线依次发生的反应所属类型不可能是( )
),按正确的合成路线依次发生的反应所属类型不可能是( )
A. ⑤⑥③① B. ⑤①④③ C. ⑤①④② D. ④①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
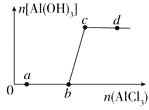
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Ag+、Ca2+、NO3-、F-
C. c点对应的溶液中:Na+、S2-、SO42-、Cl-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 ,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )
A. 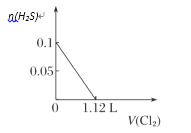 B.
B. 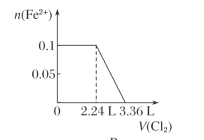
C. 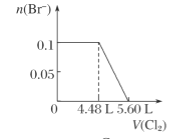 D.
D. 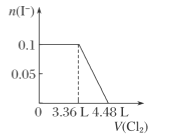
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.SiO2溶于水显酸性
B.SiO2是一种空间立体网状结构的晶体,熔点高、硬度大
C.光导纤维导电能力很强,是一种很好的通信材料
D.SiO2是一种酸性氧化物,它可以与NaOH溶液反应,但不与任何酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的说法中正确的是( )
A.自然界中硅元素的含量最丰富B.自然界中存在大量单质硅
C.高纯度的硅被用于制作计算机芯片D.光导纤维的主要成分是硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com