
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7),其主要反应为
①4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4![]() Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
A. 反应①和②均为氧化还原反应
B. 反应①,转移4 mol电子时,被氧化的为O2为1mol
C. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
D. 生成1 mol Na2Cr2O7时共转移5 mol电子
【答案】C
【解析】分析:A、化学反应中有元素化合价变化的反应是氧化还原反应,没有化合价变化的化学反应不是氧化还原反应;
B、根据元素化合价变化判断;
C、得电子化合价降低的物质是氧化剂,失电子化合价升高的物质是还原剂;
D、反应只有O元素的化合价降低,由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,由方程式可知计算Na2CrO4与转移电子数,再换算为生成1mol的Na2Cr2O7时转移电子数。
详解:A、反应①中有元素化合价的变化,所以是氧化还原反应,而反应②中没有元素化合价的变化,所以不是氧化还原反应,A错误;
B、反应①的氧气中氧元素得电子化合价降低,发生得到电子的还原反应,氧气被还原,B错误;
C、反应①的氧气中氧元素得电子化合价降低,所以氧化剂是氧气,铁元素和铬元素失电子化合价升高,所以还原剂是FeOCr2O3,C正确;
D、由方程式4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2转移电子可知,生成1molNa2CrO4时,参加反应的O2的物质的量为7/8 mol,反应中O元素由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,转移电子的物质的量为7/8 mol×4=3.5mol,所以反应①中每生成1molNa2CrO4时电子转移3.5mol,反应②不是氧化还原反应,所以生成1molNa2Cr2O7时转移7mol电子,D错误;答案选C。
8Na2CrO4+2Fe2O3+8CO2转移电子可知,生成1molNa2CrO4时,参加反应的O2的物质的量为7/8 mol,反应中O元素由0价降低为-2价,电子转移的物质的量为参加反应的氧气的物质的量的4倍,转移电子的物质的量为7/8 mol×4=3.5mol,所以反应①中每生成1molNa2CrO4时电子转移3.5mol,反应②不是氧化还原反应,所以生成1molNa2Cr2O7时转移7mol电子,D错误;答案选C。


科目:高中化学 来源: 题型:
【题目】现代以石油为基础的三大合成材料是( )
①合成氨 ②塑料 ③医药 ④合成橡胶 ⑤合成尿素 ⑥合成纤维 ⑦合成洗涤剂.
A. ②④⑥ B. ②④⑦ C. ①③⑤ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )

A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:
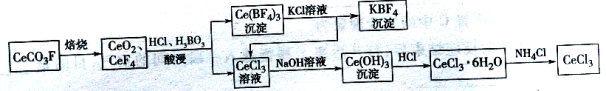
请回答下列问题:
(1)CeCO3F中,Ce元素的化合价为 。
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式: 。
(3)向Ce(BF4)3中加入KCl溶液的目的是 。
(4)溶液中的C(Ce3+)等于1×10-5mol.l-1,可认为Ce3+沉淀完全,此时溶液的PH为 。(已知KSP[Ce(OH)3]=1×10-20)
(5)加热CeCl3 .6H2O和NH4Cl的固体混合物可得到无水CeCl3 ,其中NH4Cl的作用是 。
(6)准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后用0.1000mol.l-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00ml标准溶液。(已知:Fe2++Ce4+=
Ce3++Fe3+)
①该样品中CeCl3的质量分数为 。
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数 (填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果与图像不相符的是
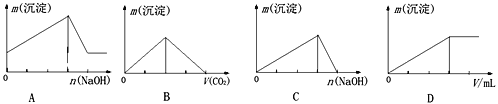
A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,用途很广,其还原性较强,在溶液中易被Cl2氧化成![]() ,常用作脱氯剂,主要用于治疗氰化物中毒。工业上可利用反应Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是( )
,常用作脱氯剂,主要用于治疗氰化物中毒。工业上可利用反应Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2制取Na2S2O3,下列说法正确的是( )
A. Na2S2O3只有还原性
B. 氧化产物与还原产物的物质的量之比为2∶1
C. 每生成1 mol Na2S2O3,转移4×6.02×1023个电子
D. 标准状况下,每吸收4 mol SO2就会放出22.4 L CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中能产生气体,但不是氧化还原反应的是( )
A. 浓盐酸与二氧化锰共热 B. 稀硫酸与硫化亚铁固体反应
C. 硝酸银与稀盐酸反应 D. 过氧化钠与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表前四周期的一部分,下列有关R、W、X、 Y、Z五种元素的叙述中,正确的是( )
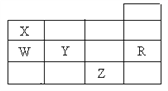
A. 通常情况下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的电负性比X的的电负性大
D. 第一电离能:R>W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是( )
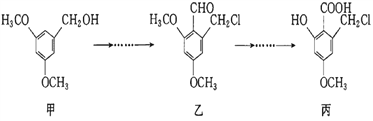
A. 乙、丙都能发生银镜反应
B. 可用FeCl3溶液鉴别甲、丙两种有机化合物
C. 甲分子中所有碳原子可能共平面
D. 乙、丙两种有机化合物均可与NaOH溶液发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com