
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是

A. 组装该电池应当在无水、无氧的条件下进行
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
D. 充电时Cl移向LiV3O8电极
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。
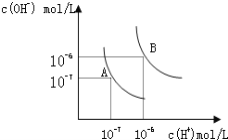
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。
(2)保持100℃的恒温,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为____________________。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________(填“酸性”,“中性”或“碱性”),醋酸体积____________氢氧化钠溶液体积。(填“ >” 或“=”或“<” )。
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,上述离子浓度大小关系中正确的是(选填字母)________。
②若上述关系中D是正确的,则溶液中的溶质为____________________;
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)= _____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)0.3molNH3中所含质子数与______gH2O分子中所含质子数相等。
(2)与3.2gSO2所含的氧原子数相等的NO2气体在标准状况下的体积为_______L。
(3)将30ml 0.5mol/L的NaOH溶液加水稀释到500ml,稀释后溶液物质的量浓度为_______。
(4)同温同压下,SO2与O2的密度比为____,若质量相同,两种气体体积比为___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
A. CO.H2S的转化率之比为1:1
B. 达平衡后H2S的体积分数为4%
C. 升高温度,COS浓度减小,表明该反应是吸热反应
D. 恒温下向平衡体系中再加入CO.H2S.COS.H2各1 mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列叙述错误的是( )
A. 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B. 在H2O2+Cl2===2HCl+O2反应中,每生成32 g氧气,则消耗NA个Cl2分子
C. 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D. 一定温度下,1 L 0.50 mol·L-1 NaCl溶液与2 L 0.25 mol·L-1 Na2CO3溶液含Na+的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳素钢是近代工业中使用最早、用量最大的金属材料。世界各工业国家在努力增加低合金高强度钢和合金钢产量的同时,也非常注意改进碳素钢质量,扩大品种和使用范围。
Ⅰ![]() 低碳钢含碳量低于0.3%,碳在钢中主要以Fe3C形式存在,则低碳钢中Fe3C的质量分数应该低于______。
低碳钢含碳量低于0.3%,碳在钢中主要以Fe3C形式存在,则低碳钢中Fe3C的质量分数应该低于______。
Ⅱ![]() 某兴趣小组同学为探究碳素钢与浓硫酸的反应,进行了以下探究实验。
某兴趣小组同学为探究碳素钢与浓硫酸的反应,进行了以下探究实验。
(1)称取一定质量碳素钢样品放入一定体积浓硫酸中,加热使碳素钢完全溶解,得到溶液M并收集到混合气体W。
①甲同学认为M中除Fe3+之外还可能含有Fe2+,若要确认其中的Fe2+,可选用______![]() 选填序号
选填序号![]()
A.氯水 ![]() 硫氰化钾溶液
硫氰化钾溶液 ![]() 浓氨水
浓氨水![]() 铁氰化钾溶液
铁氰化钾溶液![]() 酸性KMnO4溶液
酸性KMnO4溶液
②乙同学取336mL(标准状况![]() 气体W通入足量溴水中,再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体W中SO2体积分数为______。
气体W通入足量溴水中,再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体W中SO2体积分数为______。
(2)根据上述实验中SO2体积分数的分析,丙同学认为气体中除SO2外,还可能含有X和Y两种气体,在标准状况下X气体的密度为0.0893g/L。为探究气体成分设计了下列探究实验装置

①反应过程中在通入W气体的同时,还要通入N2,其作用是______。
②装置B中试剂的作用是______,装置D中盛装的试剂是______,装置G的作用是______。
③如果气体W中含有X,预计实验现象应是______。
④分析W气体中的Y气体是如何生成的______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用氯化铵熔烧菱锰矿制备高纯碳酸锰的流程如图所示:

已知:①菱锰矿的主要成分是MnCO3,其余为Fe、Ca、Mg、Al等元素。②部分阳离子沉淀时溶液的pH;
离子 | Al3+ | Fe3+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 4.1 | 2.2 | 10.6 | 8.1 | 9.1 |
沉淀完全的pH | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
③焙烧过程中主要反应为MnCO3+2NH4C1![]() MCl2+2NH3↑+CO2↑+H2O
MCl2+2NH3↑+CO2↑+H2O
(1)合1、2、3,分析焙烧过程中最佳的焙烧温度、焙烧时间、c(NH4C1)/c(菱锰矿粉)分别为______、______、______。

(2)对浸出液净化除杂时,需先加入MnO2,作用是______,再调节溶液pH的最大范围为______,将Fe3+和Al3+变为沉淀面除去,然后加人NH4F将Ca2+、Mg2+变为氧化物沉淀除去。
(3)”碳化结品”步骤中,加入碳酸氢铵时反应的离子方程式为______。
(4)上述流程中可循环使用的物质是______(填化学式)。
(5)现用滴定法测定产品中锰的含量。实验步骤:称取4.000g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnO2完全转化为[Mn(PO4)2]3-(其中NO3-转化为NO2-);加入稍过量的硫酸,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00mL0.500molL-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00mL0.500molL-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为______。
②试样中锰的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铜和浓硫酸制备SO2的方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,现用3.2gCu与一定量的浓硫酸反应制SO2气体,铜完全溶解。请计算:
CuSO4+SO2↑+2H2O,现用3.2gCu与一定量的浓硫酸反应制SO2气体,铜完全溶解。请计算:
(1)求标准状况下产生SO2体积为多少______ L?
(2)若将反应后的溶液加水稀释至500mL,求反应后CuSO4溶液的浓度为多少______ mol·L-1?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验目的、装置、现象及对应发生反应的方程式均正确的是
选项 | 目的 | 装置 | 现象 | 方程式 |
A | 验证SO2性质 |
| A中出现浑浊; B中颜色变浅 | A:SO2+Ba2++2OH-=BaSO3↓+H2O B:5SO2+2H2O+2MnO4— =5SO42—+2Mn2++4H+ |
B | 鉴别Br2(g)与NO2(g) |
| 通NO2所得溶液无色;通Br2所得溶液呈黄色 | 3NO2+H2O=2HNO3+NO Br2+H2O=2H++Br-+BrO- |
C | 检验Fe3+ |
| 滴加铁氰化钾溶液,产生蓝色沉淀 | 2Fe3++3[Fe(CN)4]2-=Fe2[Fe(CN)4]3↓ |
D | 探究浓度对反应速率的影响 |
| 注射器中收集到气体,测定收集一定体积气体所需时间 | Zn+H2SO4=ZnSO4+H2↑ |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com