
分析 (1)根据碳酸钙质量与需要的热量呈正比关系计算;
(2)根据(1)计算可知需要总热量,再根据碳的质量与放出的热量呈正比关系计算.
解答 解:(1)分解100g CaCO3需要177.7kJ的热量,煅烧1t石灰石需要热量为177.7kJ×$\frac{1×1{0}^{6}g}{100g}$=1777000kJ,
答:煅烧1t石灰石需要1777000kJ热量;
(2)12g碳完全燃烧,则放出393kJ的热,热量全部由碳燃烧提供,问理论上要消耗碳12g×$\frac{1777000kJ}{393kJ}$=54259.542g,
故答案为:热量全部由碳燃烧提供,问理论上要消耗54259.542g碳.
点评 本题考查反应热有关计算,比较基础,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 酸能使紫色石蕊溶液变红.通入CO2后的紫色石蕊溶液变红,所以CO2是酸 | |
| B. | 酸性溶液的pH小于7.食醋是酸性溶液,所以食醋的pH小于7 | |
| C. | 在同一化合物中,金属元素显正价,所以非金属元素一定显负价 | |
| D. | 溶液中有晶体析出时,溶质质量减小,所以溶质的质量分数一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)═2NO(g)+O2(g)△H>0 | B. | 2 CO(g)═C(s)+CO2(g)△H>0 | ||
| C. | N2(g)+3H2(g)═2NH3(g)△H<0 | D. | 2O3(g)═3O2(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 在电子云示意图中,小黑点密集表示电子在核外空间单位体积内电子出现的机会多 | |
| C. | 强电解质溶液一定比弱电解质溶液的导电能力强 | |
| D. | 常用原子光谱进行有机物相对分子质量的测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
| A. | 常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好 | |
| B. | 常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好 | |
| C. | 向含有Mg2+,Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021 | |
| D. | 无法利用Ca(OH)2制备NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
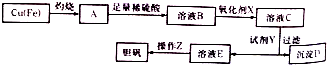
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com