
(16分)影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响反应速率的因素。甲同学的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
| ②____________ | | 反应物浓度越大,反应速率越快 |
(1)向等体积浓度分别为 0.5 mol/L、2 mol/L溶液中投入大小、形状相同的Fe或者Mg
(2)研究金属(或反应物)本身的性质与反应速率的关系 温度相同
(3)测定一定时间内产生气体的体积(或产生一定体积的气体所需时间)
(4)Mg(或Fe)、0.5 mol·L-1硫酸和2 mol·L-1硫酸;常温下Mg和18.4 mol·L-1浓硫酸反应生成SO2;Fe在18.4 mol·L-1浓硫酸中发生钝化;(5)MnSO4(或Mn2+)的催化作用;(6)B;
解析试题分析:(1)甲同学表中实验步骤②为向等体积浓度分别是0.5 mol/L、2 mol/L的硫酸中加入投入大小、形状相同的Fe或者Mg。发现:同一种金属在不同浓度的硫酸中发生反应时,浓度的大的速率快。(2)甲同学的实验目的是研究金属(或反应物)本身的性质与反应速率的关系。要得出正确的实验结论,还需控制的实验条件是反应温度应该相同,这样才能形成对照实验。(3)乙同学在实验中应该测定的数据是相同时间内产生气体的体积的多少或者产生相同体积的气体所需要的时间的长短。若相同的时间内产生的气体体积越大,则反应速率越快;或者收集相同体积的气体,需要的时间越短,则反应速率越快。(4)乙同学完成该实验应选用的实验药品是Mg(或Fe)、0.5 mol·L-1硫酸和2 mol·L-1硫酸;在该实验中不能选用18.4 mol/L硫酸,是因为Fe在浓硫酸中会发生钝化现象;而Mg与18.4 mol/L硫酸发生反应得到硫酸镁、SO2、反应原理发生了改变。(5)针对该实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是反应产生的Mn2+对反应起催化剂的作用,使反应速率大大加快。(6)若是Mn2+对反应起催化剂的作用,只要加入的物质中含有+2价的锰元素就可以。分析各个选项,可知应该加入硫酸锰。选项为B。
考点:考查影响化学反应速率的因素的知识。


科目:高中化学 来源: 题型:填空题
(6分) 在一定温度下,将4mol SO2与2molO2放入4L的密闭容器中,在一定条件下反应,10分钟时达到平衡: 2SO2 + O2 2SO3 测得平衡时混合物总物质的量为5mol,求:
2SO3 测得平衡时混合物总物质的量为5mol,求:
(1)10分钟时O2的反应速率为 mol/(L·min)(2)平衡时SO2的转化率
(3) 平衡常数K为多少
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)(1)某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示。由图中数据分析,该反应的化学方程式为:____________________________
(2) 用Z表示从0—2min内该反应的平均反应速率为
____________________
(3) 某时刻t(t﹤5min)测得Y、Z两者的物质的量之比为
3:1,则X的转化率为_________
(4) 该条件下,能说明反应已达到平衡状态的是
a.容器内z物质的量浓度为0.25mol/L
b.正反应和逆反应的速率都为0
c.容器内X、Y、Z物质的量之比为1∶3∶2
d.容器内X气体的体积分数不变
e. 单位时间内消耗3a mol X,同时生成2a mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分) 某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如下图1所示的装置。
(1)检查图1所示装置气密性的方法是____________________。
(2)若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量__________________________。
(3)实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)氮的化合物是中学化学的重要物质,与人类生活密切相关。
(1)金属与不同密度的硝酸溶液反应所得的还原产物比较复杂,如图所示: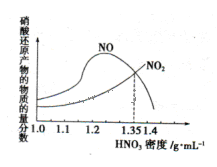
请写出铁与密度为1.35 g.m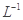 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.
(2)亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成棕色溶液和NO,则该反应中氧化剂与还原剂的物质的量之比为____。
(3)如图甲为NO2和C0反应生成CO2和NO过程的能量变化示意图,请写出该反应的热化学方程式:__________________________________________________________.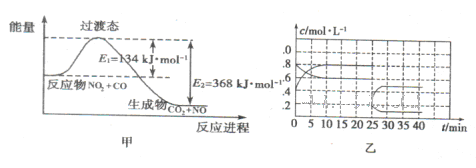
(4)已知NO2和N2O4可以相互转化:2NO2(g)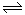 N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
①前10 min内用NO2表示的平均反应速率v(NO2)= ;上述反应的平衡常数K=__________。
②反应进行至25 min时,曲线发生变化的原因是________________________.
③若要使上述反应的平衡常数K增大,采取的措施是_________________。
| A.加入催化剂 | B.缩小容器体积 | C.降低温度 | D.再加入一定量的NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
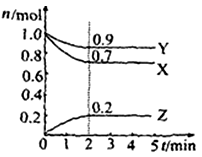
mA(气) + nB(气) pC(气) + qD(气)的 C %与时间 t有如图关系
pC(气) + qD(气)的 C %与时间 t有如图关系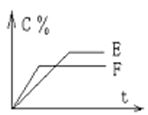
(1)若E、F表示两种温度,则 E____F(填“>”、“<”或“=”),正反应____ 热。
(2)若E、F表示两种压强,则 m + n_____p + q。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废水中常含有一定量的Cr2O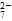 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为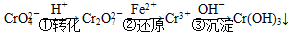
其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O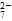 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O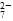 和CrO
和CrO 的浓度相同
的浓度相同
b.2v(Cr2O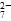 )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O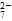 离子,需要______mol的FeSO4·7H2O。
离子,需要______mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O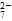 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
(5)用Fe做电极的原因为______________________________________
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________________,溶液中同时生成的沉淀还有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com