
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1.9 mol/L |
| B、2.8 mol/L |
| C、4.3 mol/L |
| D、4.9 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳的燃烧热大于 110.5kJ/mol |
| B、稀硫酸与浓NaOH溶液反应的中和热为△H=-57.3kJ/mol |
| C、稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3kJ |
| D、①表示2mol C(s)燃烧生成2mol CO(g)需要吸收221kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
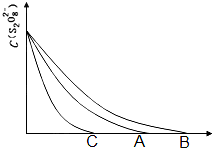 碘在科研与生活中有重要应用.
碘在科研与生活中有重要应用.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图1所示:
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| J | ||||
| R |
| I1 | I2 | I3 | I4 | … | |
| 电离能(kJ/mol) | 578 | 1817 | 2745 | 11578 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com