
【题目】回答下列各题:
(1)用电子式表示H2O和MgBr2的形成过程:H2O______________;MgBr2______________。
(2)写出CO2、Na2O2的电子式:CO2______________、Na2O2______________。
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应生成氮化钡。可用如图装置制备氮化钡。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自燃,遇水反应。下列说法不正确的是( )
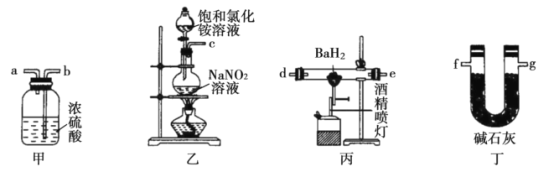
A.在实验室中可以用装置乙制备氯气
B.实验时,先点燃装置丙中的酒精喷灯,后点燃装置乙中的酒精灯
C.气流从左向右的字母连接顺序为c→b→a→d→e→g→f
D.装置甲中的浓硫酸和装置丁中的碱石灰作用相同,均可防止水蒸气进入装置丙中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬的工艺流程如图:
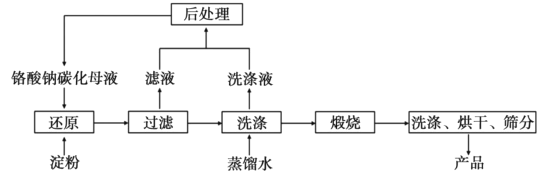
已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液。
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式__。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是__(填标号)。
A.该反应一定无需加热即可进行
B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应
D.应建造废水回收池,回收含铬废水
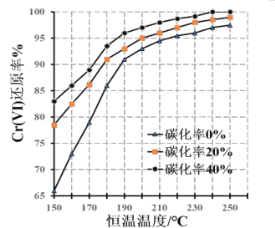
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_、__。
(4)滤液中所含溶质为__。该水热法制备氧化铬工艺的优点有__、__(写出两条即可)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[2Cr(OH)3H2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,失去质量与固体残留质量比为_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新型冠状病毒(2019-nCoV)有明显抑制作用;K为药物合成的中间体,其合成路线如图(A俗称石炭酸):

已知:①R—OH![]() R—Cl
R—Cl
②![]()
回答下列问题:
(1)有机物B的名称为__。
(2)I中官能团的名称为__。
(3)G到H的反应类型为__。
(4)由B生成C的化学反应方程式为__。
(5)E中含两个Cl原子,则E的结构简式为__。
(6)X是C的同分异构体,写出满足下列条件的X的结构简式__。(写出一种即可)
①苯环上含有硝基且苯环上只有一种氢原子;②1molX最多消耗2molNaOH。
(7)设计由苯甲醇为原料制备化合物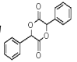 的合成路线___。(无机试剂任选。合成路线常用的表示方式为:A
的合成路线___。(无机试剂任选。合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
B. 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA
C. NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA
D. 1 mol Fe在氧气中充分燃烧失去3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验过程如图所示,则图③试管中的现象是( )
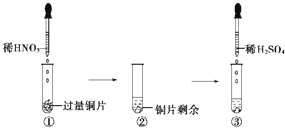
A.铜片溶解,产生无色气体,该气体遇空气变为红棕色
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.无明显现象,因稀硫酸不与铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某同学做如下实验,以探究反应中的能量变化。
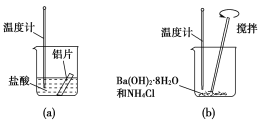
(1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是________热反应;(b)中温度降低,由此可以判断(b)中反应是________热反应。
(2)根据能量守恒定律,(b)中反应物的总能量应该________生成物的总能量。
II.某学习小组依据氧化还原反应原理:2Ag++Cu=Cu2++2Ag设计成的原电池如右图所示。
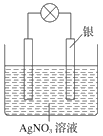
(3) 从能量转化角度分析,上述原电池将化学能转化为_________ ;
(4) 负极的电极材料为_____________;
(5) 正极发生的电极反应__________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列说法错误的是( )
表示阿伏加德罗常数的值,下列说法错误的是( )
A.56g铁在足量氧气中完全燃烧,转移的电子数小于![]()
B.在![]() 反应中,若有212g氯气生成,则反应中电子转移的数目为
反应中,若有212g氯气生成,则反应中电子转移的数目为![]()
C.![]() 和
和![]() 的混合物中所含中子数为
的混合物中所含中子数为![]()
D.常温下,![]()
![]()
![]() 溶液的
溶液的![]() ,则溶液中
,则溶液中![]() 与
与![]() 的数目均为
的数目均为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com