
【题目】已知:2H2O(l)===2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:

过程Ⅰ:2Fe3O4(s) === 6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是
A. 过程Ⅰ中每消耗232g Fe3O4转移2mol电子
B. 过程Ⅱ热化学方程式为:3FeO(s)+H2O(l) ===H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol
C. 过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D. 铁氧化合物循环制H2具有成本低、产物易分离等优点
【答案】C
【解析】
由循环分解水制H2的过程可知,过程Ⅰ为太阳能转化为热能,Fe3O4在热能的作用下分解生成O2和FeO,过程Ⅱ为氧化亚铁与水反应生成四氧化三铁和氢气,总反应为水分解生成氢气和氧气,反应过程中Fe3O4为催化剂。
A项、过程Ⅰ中每消耗232g Fe3O4反应生成,0.5mol O2,反应转移0.5mol×4 mol电子,故A正确;
B项、由盖斯定律可知,(总反应×1/2—过程Ⅰ×1/2)反应得过程Ⅱ反应,3FeO(s)+H2O(l) =H2(g)+Fe3O4(s) 则ΔH=[+571.0kJ/mol×1/2—(+313.2kJ/mol)×1/2]=+128.9 kJ/mol,故B正确;
C项、过程Ⅰ和过程Ⅱ都是吸热反应,过程Ⅰ是将光能转化为热能,热能转化为化学能,过程Ⅱ中能量转化的形式不是化学能转化为热能,应该还是热能转化为化学能,故C错误;
D项、铁氧化合物循环制H2以太阳能为热源分解Fe3O4,以水和Fe3O4为原料,具有成本低的特点,氢气和氧气分步生成,具有产物易分离的优点,故D正确。
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 食盐溶液静置会分层,上层比下层咸
B. “冰水混合物”是一种分散系
C. 黄河入海口处三角洲的形成与胶体性质有关
D. 电泳现象说明胶体带电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:

(1)温度T1____________T2(填大于、等于或小于)。
(2)正反应是_________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m______2(填大于、等于或小于)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填增大、减小或不变),平衡_________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究柠檬电池的工作原理时,某课外小组同学发现:当按图Ⅰ所示连接一个柠檬时,二极管不发光;按图Ⅱ所示连接几个柠檬时,二极管发光。下列说法不正确的是

A. 图Ⅰ中二极管不发光,说明该装置不构成原电池
B. 图Ⅱ中铁环为负极、铜线为正极,负极的电极反应为:Fe-2 e-===Fe2+
C. 图Ⅰ中二极管不发光的原因是单个柠檬电池的电压较小
D. 图Ⅱ中所得的电池组的总电压是各个柠檬电池的电压之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g火箭燃料肼(N2H4)气体燃烧生成N2和H2O(g)时,放出16.7kJ的热量,则该反应的热化学方程式正确的是
A. N2H4+O2=N2+2H2O △H=-534.4kJ/mol
B. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.4kJ/mol
C. N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= +534.4kJ/mol
D. ![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) △H=-16.7kJ/mol
N2(g)+H2O(g) △H=-16.7kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)26H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:FeS2与H2SO4不反应。相应物质的溶解度曲线如下图。
(1)FeS2中S元素的化合价为______。
(2)硫铁矿焙烧的主反应是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
(3)加H2SO4酸浸,发生反应的离子方程式为______。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。反应Ⅰ为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+反应Ⅱ的离子方程式为:______。
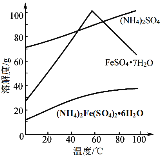
(5)得到莫尔盐晶体的操作是:蒸发浓缩、结晶、过滤、洗涤。结晶、过滤时选择的适宜温度为60℃,解释选择该温度的原因______。
(6)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中,______,证明含有Fe2+和NH4+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com