
【题目】硫酸亚铁铵(NH4)2Fe(SO4)26H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:FeS2与H2SO4不反应。相应物质的溶解度曲线如下图。
(1)FeS2中S元素的化合价为______。
(2)硫铁矿焙烧的主反应是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
(3)加H2SO4酸浸,发生反应的离子方程式为______。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。反应Ⅰ为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+反应Ⅱ的离子方程式为:______。
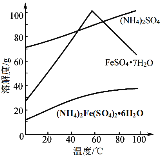
(5)得到莫尔盐晶体的操作是:蒸发浓缩、结晶、过滤、洗涤。结晶、过滤时选择的适宜温度为60℃,解释选择该温度的原因______。
(6)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中,______,证明含有Fe2+和NH4+。
【答案】-1 将硫铁矿粉碎、增大通入空气的量或提高焙烧温度 Fe2O3+ 6H+ = 2Fe3++3H2O FeS2 +2Fe3+ = 3Fe2++2S 60℃时,硫酸亚铁晶体的溶解度最大,硫酸铵较大,均比莫尔盐溶解度大,结晶时不宜析出,因此,选择60℃结晶、过滤,得到莫尔盐晶体的纯度更高 加入适量浓氢氧化钠溶液,溶液中的白色沉淀迅速变灰绿,最终变为红褐色(1分);微热,用湿润的红色石蕊试纸接近试管口,观察到湿润的红色石蕊试纸变蓝(1分),证明含有Fe2+和NH4+
【解析】
硫铁矿焙烧时,FeS2与氧气高温下反应生成氧化铁和二氧化硫;加入稀硫酸,稀硫酸与氧化铁反应生成硫酸铁和水;硫酸铁和FeS2反应生成硫酸亚铁、硫(或硫酸);硫酸亚铁溶液与硫酸铵溶液按一定比例混合,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得硫酸亚铁铵晶体。
(1)FeS2中Fe元素呈+2价,S元素呈—1价,故答案为:—1价;
(2)焙烧时,如果将硫铁矿粉碎,增大固体表面积,增加反应物的接触面积,可以加快硫铁矿焙烧速率;如果鼓入过量空气,增大氧气浓度,可以加快硫铁矿焙烧速率;如果升高温度,增大活化分子数,可以加快反应速率,故答案为:将硫铁矿粉碎、增大通入空气的量或提高焙烧温度;
(3)加H2SO4酸浸时,氧化铁与硫酸反应生成硫酸铁和水,反应的离子方程式为Fe2O3+ 6H+ = 2Fe3++3H2O。故答案为:Fe2O3+ 6H+ = 2Fe3++3H2O;
(4)由流程图可知,“还原”时,Fe3+和FeS2反应生成硫酸亚铁、硫(或硫酸),则反应Ⅱ为FeS2 +2Fe3+ = 3Fe2++2S,故答案为:FeS2 +2Fe3+ = 3Fe2++2S;
(5)由图可知,当温度为60℃时,硫酸亚铁晶体的溶解度最大,硫酸铵较大,均比莫尔盐溶解度大,结晶时不宜析出,因此,选择60℃结晶、过滤,得到莫尔盐晶体的纯度更高,故答案为:60℃时,硫酸亚铁晶体的溶解度最大,硫酸铵较大,均比莫尔盐溶解度大,结晶时不宜析出,因此,选择60℃结晶、过滤,得到莫尔盐晶体的纯度更高;
(6)Fe2+和NH4+均能与碱反应,Fe2+与氢氧化钠溶液反应,溶液中立即生成白色沉淀,白色沉淀迅速变灰绿,最终变为红褐色;NH4+微热与氢氧化钠溶液反应,生成能使红色石蕊试纸变蓝的气体,故答案为:加入适量浓氢氧化钠溶液,溶液中的白色沉淀迅速变灰绿,最终变为红褐色;微热,用湿润的红色石蕊试纸接近试管口,观察到湿润的红色石蕊试纸变蓝,证明含有Fe2+和NH4+。


科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是_____________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(4)室温下,使用pH计测定0.1 mol/LNH4Cl溶液的pH=5.12。由此可以得到的结论是_______(填字母)。
a.溶液中c(H+)>c(OH-) b.NH4+水解是微弱的
c.NH3·H2O是弱碱 d.由H2O电离出的c(H+)<10-7 mol/L
e.物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7
(5)某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是____,

A.a点导电能力比b点强
B.b点的KW值大于c点
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.a、c两点c(H+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸、冬青油、阿司匹林的结构简式如下,下列说法不正确的是

A. 由水杨酸制冬青油的反应是取代反应
B. 冬青油苯环上的一氯取代物有4种
C. 可用FeCl3溶液检验阿司匹林中是否混有水杨酸
D. 相同物质的量的冬青油和阿司匹林消耗NaOH的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)===2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:

过程Ⅰ:2Fe3O4(s) === 6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是
A. 过程Ⅰ中每消耗232g Fe3O4转移2mol电子
B. 过程Ⅱ热化学方程式为:3FeO(s)+H2O(l) ===H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol
C. 过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D. 铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛分布于植物、昆虫及微生物体内,是多种香料和药物的主要成分。I是一种萜类化合物,它的合成路线如下:


回答下列问题:
(1)按官能团分类,A的类别是______。
(2)A→C的反应类型是______。
(3)C→D、E→F的化学方程式分别是______、______。
(4)写出下列物质的结构简式:B______、H______。
(5)F→G的反应中,乙酸酐的作用______。
(6)十九世纪末O.Wallach发现并提出了“异戊二烯法则”,即自然界中存在的萜类化合物均可以看作是异戊二烯的聚合体或衍生物,为表彰他对萜类化合物的开创性研究,1910年被授予诺贝尔化学奖。请以CH3CH2OH、CH3MgI、CH3CH2MgBr为有机原料,结合题目所给信息,选用必要的无机试剂,补全异戊二烯(![]() )的合成路线____________________。
)的合成路线____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向lOmL 1 mol L-1的HCOOH溶液中不断滴加1 mol L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc(H+)的关系如图所示。c(H+)为溶液中水电离出的c(H+)。下列说法正确的是()

A. HCOOH为强电解质
B. a、b两点pH均为7
C. 混合溶液的pH逐渐增大
D. 从a点到b点,溶液的导电性先增强后减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、X、N、Z、Y原子序数依次增大的短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素名称:X________,M________。
(2) Y在周期表中的位置______________,写出Z的氢化物的电子式_____________
(3) N的氧化物与氢氧化钠溶液反应的化学方程式_________________。
(4)Y与Z的最高价氧化物对应水化物的酸性强弱顺序________>________(用化学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com