
【题目】水杨酸、冬青油、阿司匹林的结构简式如下,下列说法不正确的是

A. 由水杨酸制冬青油的反应是取代反应
B. 冬青油苯环上的一氯取代物有4种
C. 可用FeCl3溶液检验阿司匹林中是否混有水杨酸
D. 相同物质的量的冬青油和阿司匹林消耗NaOH的物质的量相同
【答案】D
【解析】
水杨酸的官能团为酚羟基和羧基,表现酚和羧酸的性质;冬青油的官能团为酚羟基和酯基,表现表现酚和酯的性质;阿司匹林的官能团为酯基和羧基,表现酯和羧酸的性质。
A项、水杨酸可与乙酸酐发生取代反应制得冬青油,故A正确;
B项、冬青油苯环上连有羟基和酯基,结构不对称,苯环上含有4种H,则一氯取代物有4种,故B正确;
C项、水杨酸的官能团为酚羟基和羧基,阿司匹林的官能团为酯基和羧基,FeCl3溶液可以酚羟基,故C正确;
D项、冬青油的官能团为酚羟基和酯基,1mol冬青油消耗2molNaOH,阿司匹林的官能团为酯基(酚酯)和羧基,1mol阿司匹林消耗3molNaOH,故D错误。
故选D。


科目:高中化学 来源: 题型:
【题目】一定温度和压强下,2体积AB2气体和1体积B2气体化合生成2体积气态化合物,则该化合物的化学式为
A. AB3 B. AB2 C. A3B D. A2B3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:

(1)温度T1____________T2(填大于、等于或小于)。
(2)正反应是_________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m______2(填大于、等于或小于)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填增大、减小或不变),平衡_________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下图是由常见元素组成的一些单质及其化合物之间的转化关系图。A是由单质C在D中燃烧生成的淡黄色固体。B是最常见的无色液体,常温常压下,D、F、K均为无色无刺激性气味的气体。H和I焰色反应均为黄色。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________。
(2)反应①的离子方程式为__________。
(3)反应②的化学方程式为_________。
(4)上述转化H→I的反应离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究柠檬电池的工作原理时,某课外小组同学发现:当按图Ⅰ所示连接一个柠檬时,二极管不发光;按图Ⅱ所示连接几个柠檬时,二极管发光。下列说法不正确的是

A. 图Ⅰ中二极管不发光,说明该装置不构成原电池
B. 图Ⅱ中铁环为负极、铜线为正极,负极的电极反应为:Fe-2 e-===Fe2+
C. 图Ⅰ中二极管不发光的原因是单个柠檬电池的电压较小
D. 图Ⅱ中所得的电池组的总电压是各个柠檬电池的电压之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)26H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:FeS2与H2SO4不反应。相应物质的溶解度曲线如下图。
(1)FeS2中S元素的化合价为______。
(2)硫铁矿焙烧的主反应是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
(3)加H2SO4酸浸,发生反应的离子方程式为______。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。反应Ⅰ为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+反应Ⅱ的离子方程式为:______。
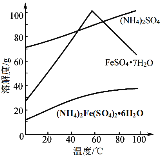
(5)得到莫尔盐晶体的操作是:蒸发浓缩、结晶、过滤、洗涤。结晶、过滤时选择的适宜温度为60℃,解释选择该温度的原因______。
(6)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中,______,证明含有Fe2+和NH4+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol/LNaOH溶液分别滴加到0.1 mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,回答下列问题:

(1)请计算出Ka(HA) =_____,Ka(HB)_____ Ka(HA) (填“大于' “等于”或“小于”)。
(2)等浓度的HA和HB溶液,若要向其中之一加水让二者pH值相等,应该向_____中加水。
(3)若分别向等浓度等体积的HA和HB溶液中加入NaOH固体让二溶液都呈中性,则 ______需要的NaOH多。
(4)a点溶液中,水电离出的c(H+)=_______。b点溶液中,c(B-)____ c(Na+)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com