
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
【答案】C
【解析】
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0,该反应为放热反应,在压强相同时,温度越低,CO的转化率越大,以此分析解答。
CH3OH(g) ΔH<0,该反应为放热反应,在压强相同时,温度越低,CO的转化率越大,以此分析解答。
A项,该反应为放热反应,温度越低,CO的转化率越大,则T1<T2<T3,故A项错误;
B项,由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,温度越低,CO的转化率越大,所以温度T1<T3,温度越高,反应速率越快,则v(a)<v(c),b、d两点温度相同,压强越大,反应速率越大,b点大于d点压强,则v(b)>v(d),故B项错误;
C项,由图可知,a、c两点压强相同,平衡时a点CO转化率更高,该反应为放热反应,所以温度T1<T3,,降低温度平衡向正反应方向移动,则K(a)>K(c),平衡常数只与温度有关,b、d两点温度相同,平衡常数相同,则K(b)=K(d),故C项正确;
D项,CO转化率的越大,n总越小,由M=m/n可知,a点n总小,则M(a)>M(c),M(b)>M(d),故D项错误。
综上所述,本题正确答案为C。


科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2Fe(SO4)26H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:FeS2与H2SO4不反应。相应物质的溶解度曲线如下图。
(1)FeS2中S元素的化合价为______。
(2)硫铁矿焙烧的主反应是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
(3)加H2SO4酸浸,发生反应的离子方程式为______。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。反应Ⅰ为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+反应Ⅱ的离子方程式为:______。
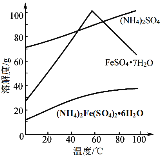
(5)得到莫尔盐晶体的操作是:蒸发浓缩、结晶、过滤、洗涤。结晶、过滤时选择的适宜温度为60℃,解释选择该温度的原因______。
(6)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中,______,证明含有Fe2+和NH4+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是 ( )

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应X(g)+2Y(g) ![]() 2Z(g) ΔH=-akJmol-1,达到化学平衡时,下列说法一定正确的是 ( )
2Z(g) ΔH=-akJmol-1,达到化学平衡时,下列说法一定正确的是 ( )
A.反应放出akJ热量B.反应物和生成物的浓度都不再发生变化
C.X和Y的物质的量之比为1∶2D.X的正反应速率等于Z的逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1 mol/LNaOH溶液分别滴加到0.1 mol/LHA溶液和HB溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,回答下列问题:

(1)请计算出Ka(HA) =_____,Ka(HB)_____ Ka(HA) (填“大于' “等于”或“小于”)。
(2)等浓度的HA和HB溶液,若要向其中之一加水让二者pH值相等,应该向_____中加水。
(3)若分别向等浓度等体积的HA和HB溶液中加入NaOH固体让二溶液都呈中性,则 ______需要的NaOH多。
(4)a点溶液中,水电离出的c(H+)=_______。b点溶液中,c(B-)____ c(Na+)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)不能作为达到平衡状态的依据的是
2NH3(g)不能作为达到平衡状态的依据的是
A. N2,H2和NH3的质量分数不再改变
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 断开1 mol H-H的同时形成1 mol H-H
D. 单位时间里每增加1 mol N2,同时消耗3 molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com