
【题目】在含有大量SO42-、OH-、Na+的溶液中,还可能大量共存的离子是
A. Ba2+ B. Cl- C. Mg2+ D. HCO3-
科目:高中化学 来源: 题型:
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
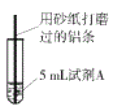
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
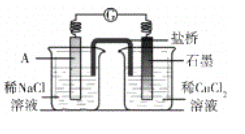
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态 ⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法不正确的是
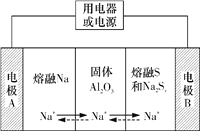
A. 放电时,电极A为负极,Na+由A极向B极移动
B. 该电池不能在常温下工作
C. 充电时,电极B连接外电源的负极
D. 放电时,B极的电极反应式为xS+2e-===S![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
C8H10(g) ![]() C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol乙苯充入1 L真空密闭容器中发生上述反应,测定不同时间该容器内物质的物质的量,得到数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均生成速率是__________。
(2)该温度下,反应从开始到平衡的过程中共从环境吸收__________kJ热量。
(3)若保持反应条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有25 kJ热量放出时,该反应中H2的转化率是______,此时该反应的方向是________(填“正向” 或“ 逆向”)。
Ⅱ.氢化热是指在一定条件下,1 mol不饱和化合物加氢时放出的热量,表中是环己烯(g)、1,3-环己二烯(g)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ/mol) | 119.7 | 232.7 | 208.4 |
(4)1,3-环己二烯的稳定性________(填“大于”“小于”或“等于”)苯。
(5)某有机物是苯的同分异构体,其分子中的碳碳键角只有60度和90度两种。请写出这种有机物的键线式结构________,它在核磁共振氢谱上会产生________个吸收峰 。
(6)与环己烯互为同分异构体的炔烃共有________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A.强碱性溶液中:K+、Mg2+、Cl﹣、SO42﹣
B.滴加石蕊试液显红色的溶液::K+、Al3+、Cl﹣、NO3﹣
C.含有0.1molL﹣1Ca2+的溶液中:Na+、K+、CO32﹣、Cl﹣
D.无色透明的酸性溶液中:MnO4﹣、K+、SO42﹣、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下,56g丙烯与环丁烷的混合气体中含有4NA个碳原子
B. 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
C. 25℃,pH=1的H2SO4溶液中,H+的数目为0.2NA
D. 1mol的P4O6中含有6 NA个P-O键(P4O6的结构如图: ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物的说法正确的是( )
A.将剩余的金属钠丢弃在废纸篓里
B.小苏打可用于制作糕点的膨松剂,苏打可用于治疗胃酸过多
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.生活中用热的烧碱溶液洗去油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是___________________________________________________ (用必要的化学用语和相关文字说明)。
(2)相同温度下,浓度均为0.1 mol/L 的下列溶液中的c(![]() )由大到小_____(填序号)。
)由大到小_____(填序号)。
①NH4Al(SO4)2 ②CH3COONH4 ③ NH4HSO4 ④NH3·H2O ⑤NH4Cl
(3)如图1是0.1 mol/L电解质溶液的pH随温度变化的图像。其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是_____(填写字母)。
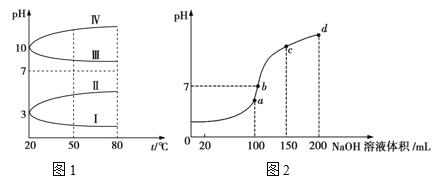
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____;在b点,溶液中各离子浓度由大到小的排列顺序是______;在cd段发生反应的离子方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com