
| A. | 有机高分子化合物称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而制得的 | |
| B. |  的单体是HOCH2OH与 的单体是HOCH2OH与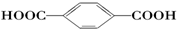 | |
| C. | 聚乙烯( )是由乙烯加聚生成的纯净物 )是由乙烯加聚生成的纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
分析 A.有机高分子化合物多是由小分子通过聚合反应而制得;
B.在高分子链中,单体转变为在化学组成上能够重复的最小单位,即链节.根据链节寻找单体:凡链节中含有酯基结构,从酯基中间断开,在羰基上加羟基,在氧原子上加氢原子得到羧酸和醇;
C.聚合物中由于聚合度不确定,则聚合物属于混合物;
D.高分子材料按来源分为天然、合成高分子材料.
解答 解:A.高分子化合物主要是由小分子通过加聚、缩聚两类反应制得,故A正确;
B.链节中含有酯基结构,从酯基中间断开,在羰基上加羟基,在氧原子上加氢原子得到其相应的单体羧酸和醇.所以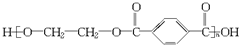 的单体是
的单体是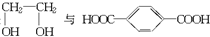 ,故B错误;
,故B错误;
C.聚乙烯分子所包含的链节数不同,即n值不同,是混合物,故C错误;
D.高分子材料按来源分为天然、合成高分子材料,故D正确.
故选BC.
点评 本题考查高分子化合物的有关知识,难度不大,加强基础知识的识记,注意进行归纳总结高分子化合物单体的寻找方法规律.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
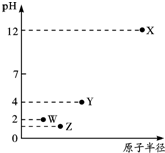
| A. | 简单离子半径:X>Y>Z>W | |
| B. | Y元素存在同素异形体 | |
| C. | 气态氢化物的稳定性:Z>W>Y | |
| D. | X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化 | |
| D. | 元素原子的核外电子排布、原子半径及元素主要化合价的都发生周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在酸性条件下水解生成M和N:
在酸性条件下水解生成M和N: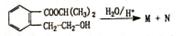
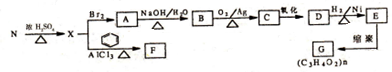
 .
.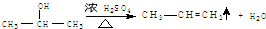 ,E转化为G的化学方程式为
,E转化为G的化学方程式为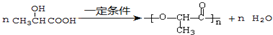 .
.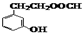 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应一定能自发的进行 | |
| B. | SO2能使品红溶液和溴水褪色,说明SO2具有漂白性 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl(s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
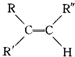 $→_{H_{2}SO_{4}}^{KMnO_{4}}$
$→_{H_{2}SO_{4}}^{KMnO_{4}}$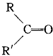 +
+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | △H1>△H2 | C. | Q1=Q2 | D. | △H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com