
【题目】随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
该催化重整反应的△H=______kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为_____。
(2)向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数(![]() )随温度变化如下表所示。
)随温度变化如下表所示。
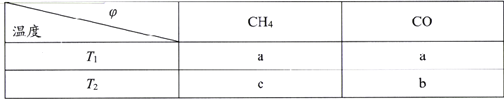
已知b>a>c,则T1______T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=_______(mol2·L-2)
(3)实验硏究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:
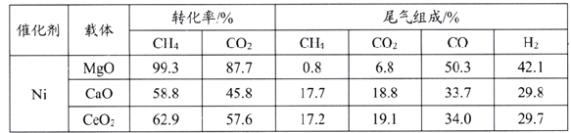
由上表判断,应选择载体为_______(填化学式),理由是________。
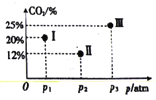
(4)现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是_______。
(5)利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g)![]() CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
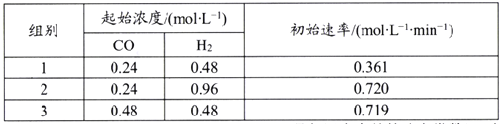
该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=____(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=______(保留1位小数)。
【答案】+247.1 升高温度 < ![]() MgO 此条件下合成气产率高 III 1 0.2mol/(L·min)
MgO 此条件下合成气产率高 III 1 0.2mol/(L·min)
【解析】
(1)依据盖斯定律作答;
(2)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)反应吸热,依据外因对化学反应速率与化学平衡的综合影响来分析;结合表格数据,依据升高温度对物质体积分数的影响效果判断温度高低,再利用甲烷与CO的平衡体积分数相等计算出转化的甲烷的物质的量,列出三段式,根据平衡常数的表达式计算解答;
2CO(g)+2H2(g)反应吸热,依据外因对化学反应速率与化学平衡的综合影响来分析;结合表格数据,依据升高温度对物质体积分数的影响效果判断温度高低,再利用甲烷与CO的平衡体积分数相等计算出转化的甲烷的物质的量,列出三段式,根据平衡常数的表达式计算解答;
(3)依据表格数据,选择合成CO和氢气量最多的物质作为载体;
(4)根据温度和压强对平衡的影响,结合平衡状态的特征回答;
(5)结合表格中三组数值,列出三个方程,解方程组即可求出n的值;再列出三段式,分别求出c(CO)与c(H2)的值,带入通式求得v正。
(1)①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
①-②可得到CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),则根据盖斯定律可知△H=+205.9 kJ·mol-1-(-41.2 kJ·mol-1)= +247.1 kJ·mol-1,因此该反应为吸热反应,要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为升高温度,
2CO(g)+2H2(g),则根据盖斯定律可知△H=+205.9 kJ·mol-1-(-41.2 kJ·mol-1)= +247.1 kJ·mol-1,因此该反应为吸热反应,要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为升高温度,
故答案为:+247.1;升高温度;
(2)同一个物质在不同的温度下所占的体积分数不同,因CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.1 kJ·mol-1,该反应为吸热反应,则升高温度则有利用平衡向正反应方向移动,导致CH4的体积分数降低,CO的体积分数升高。已知b>a>c,根据图表信息可知,T1<T2;T1下该反应的CH4与CO的体积分数均为a,则设CH4转化浓度为x mol/L,
2CO(g)+2H2(g) △H=+247.1 kJ·mol-1,该反应为吸热反应,则升高温度则有利用平衡向正反应方向移动,导致CH4的体积分数降低,CO的体积分数升高。已知b>a>c,根据图表信息可知,T1<T2;T1下该反应的CH4与CO的体积分数均为a,则设CH4转化浓度为x mol/L,

则根据T1下该反应的CH4与CO的体积分数均为a易知,![]() ,解得x=
,解得x=![]() ,所以平衡常数
,所以平衡常数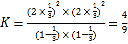 ,
,
故答案为:<;![]() ;
;
(3)从表中可以看出,MgO的原料转化率较高,且合成气的产率较高,所以选择MgO作为载体,
故答案为:MgO;此条件下合成气产率高;
(4)由于不能确定容器Ⅱ中二氧化碳的体积分数是否达到最小值,因此不能确定Ⅱ是否达到平衡状态,若未达平衡,压强越高反应逆向移动,相同时间内二氧化碳的含量越高,p3时,二氧化碳Ⅲ的含量比Ⅱ高,故Ⅲ到达平衡,
故答案为:III;
(5)组别1中c(CO)=0.24mol/L,c(H2) =0.48 mol/L,初始速率v正=0.361 mol/(L·min);则依据ν正=k正cm(CO)·cn(H2)可知,①0.361 mol/(L·min)=k正×(0.24 mol/L)m×(0.48 mol/L)n;同理,根据表格数据可得②0.720 mol/(L·min)=k正×(0.24 mol/L)m×(0.96 mol/L)n;③0.719 mol/(L·min)=k正×(0.48 mol/L)m×(0.48 mol/L)n;则②/①可得2=2n,即n=1;③/①得2=2m,则m=1;带入①得k正=3.134 L /min·mol。若该温度下平衡CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),组别1的产率为25%,设转化的CH4的物质的量浓度为y mol/L,则
2CO(g)+2H2(g),组别1的产率为25%,设转化的CH4的物质的量浓度为y mol/L,则

则![]() ,则y=0.12,则c(CO)=2y=0.24mol/L,c(H2) =2y=0.24 mol/L,k正是与温度有关的速率常数,保持不变,则依据给定公式可得ν正=k正c(CO)·c(H2)= 3.134 L /min·mol×0.24mol/L×0.24mol/L=0.180
,则y=0.12,则c(CO)=2y=0.24mol/L,c(H2) =2y=0.24 mol/L,k正是与温度有关的速率常数,保持不变,则依据给定公式可得ν正=k正c(CO)·c(H2)= 3.134 L /min·mol×0.24mol/L×0.24mol/L=0.180![]() 0.2 mol/(L·min),
0.2 mol/(L·min),
故答案为:1;0.2mol/(L·min)。


科目:高中化学 来源: 题型:
【题目】化合物G(盐酸阿扎司琼,Azasetronhydrochchoride)主要用于治疗和预防肿瘤术后以及化疗引起的恶心、呕吐。G的合成路线设计如图:
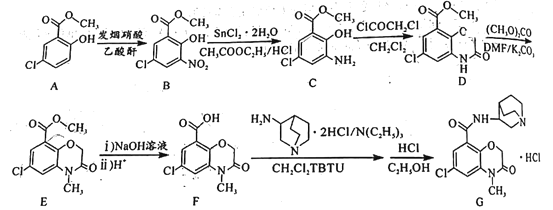
回答下列问题:
(1)A中含有的官能团名称为__。
(2)A生成B、B生成C的反应类型分别为__、__,D的分子式为__。
(3)上述合成路线中,互为同分异构体的物质是__(填字母序号)。
(4)E生成F的第一步反应的化学方程式为__。
(5)X为A的同分异构体,写出两种满足以下条件的X的结构简式__。
①含有苯环,且苯环上有4个取代基;
②有四种不同化学环境的氢,个数比为2:2:2:1;
③能发生银镜反应,还能与氯化铁溶液发生显色反应。
(6)以![]() 和(CH3O)2CO为原料制备
和(CH3O)2CO为原料制备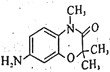 ,写出合成路线:__(无机试剂和有机溶剂任选)。
,写出合成路线:__(无机试剂和有机溶剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低
B. 利用电解法精炼粗铜时,精铜板做阴极,粗铜做阳极,CuSO4溶液做电解液
C. FeCl3溶液加热蒸干、灼烧得到Fe2O3
D. 用惰性电极电解MgCl2溶液,阴极得到单质Mg,阳极得到Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
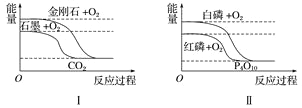
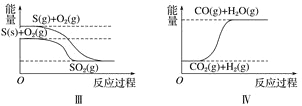
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,针对表中①~⑧元素,回答下列问题
① | |||||||||||||||
② | ③ | ④ | |||||||||||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)③元素在周期表中的位置是第二周期第_____________族
(2)写出②的最高价氧化物的电子式_____________
(3)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是_____________(填化学式)
(4)写出③和⑦的常见氢化物中稳定性较好的的物质的电子式_____________
(5)写出⑤⑧的最高价氧化物对应水化物互相反应的离子方程式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理为H2SO4(浓)+NaBr![]() NaHSO4+HBr↑、CH3CH2OH+HBr
NaHSO4+HBr↑、CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
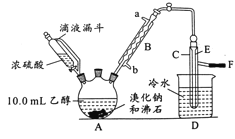
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是__,B中进水口为__口(填“a”或“b”)。
(2)实验中用滴液漏斗代替分液漏斗的优点为__。
(3)氢溴酸与浓硫酸混合加热发生氧化还原反应的化学方程式__。
(4)给A加热的目的是__,F接橡皮管导入稀NaOH溶液,其目的是吸收__和溴蒸气,防止__。
(5)C中的导管E的末端须在水面以下,其原因是__。
(6)将C中的镏出液转入锥形并瓶中,连振荡边逐滴滴入浓H2SO41~2mL以除去水、乙醇等杂质,使溶液分层后用分液漏斗分去硫酸层;将经硫酸处理后的溴乙烷转入蒸镏烧瓶,水浴加热蒸馏,收集到35~40℃的馏分约10.0g。
①分液漏斗在使用前必须__;
②从乙醇的角度考虑,本实验所得溴乙烷的产率是__(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐增大
D.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢毒性很大,俗称“一口闷”,工业废水中的硫化物在酸性条件下会以硫化氢的形式逸出。某课外小组以碘量法测定废水中的硫化物,实验装置如图所示,实验步骤及测定原理如下:
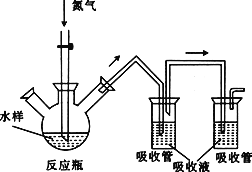
Ⅰ.取样、吹气、固硫
连接装置,打开氮气源,检查装置气密性。移取一定体积1mol·L-1乙酸锌溶液于两支吸收管中,取200mL水样于反应瓶中,通入氮气一段时间。移取10mL盐酸于反应瓶中,水浴加热,继续通入氮气。已知乙酸锌与硫化氢反应生成硫化锌沉淀(硫化氢被完全吸收)。
Ⅱ.滴定
关闭气源,往两个吸收管中各加入0.010mol·L-1的碘标准溶液100mL(过量),再加入盐酸5mL,静置。加入淀粉指示液,用0.010mol·L-1的硫代硫酸钠标准溶液对两支吸收管中的液体进行滴定。(已知:![]() )
)
回答下列问题:
(1)水浴加热的温度不能高于85℃,原因是_____________________________。
(2)加入碘标准溶液时,吸收管中发生反应的化学方程式为________________。
(3)该实验使用两个吸收管的原因是_____________________________,若只使用一个吸收管,会导致测定结果偏______________________(填“高”或“低”)。
(4)该200mL水样经吹气、固硫后,滴定操作时共消耗160mLNa2S2O3溶液,则废水中硫的含量为________mg·L-1。
(5)实验室常用FeS固体与酸反应制取H2S。实验室制取H2S时,从反应物与生成物的状态、性质和反应条件分析,下列发生装置中可选用的是________(填序号)。

(6)将二氧化氯溶液加入硫化氢溶液中,然后加入少量稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成。写出二氧化氯与硫化氢溶液反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列正确的叙述有
① CO2、SO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③ 碘晶体分散到酒精中、淀粉溶于水中所形成的分散系分别为:溶液、胶体
④ 灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均属于氧化还原反应,又是吸热反应
⑤ 需要通电才可进行的有:电离、电解、电泳、电镀、电化学腐蚀
⑥ 氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铁生成
⑦ 按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO4·5H2O、盐酸、苛性钾、次氯酸、氨气
⑧ 金属元素和非金属元素形成的化合物不一定是离子化合物
A. 3个B. 4个C. 5个D. 6个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com