
【题目】2.3g钠跟水反应后,得到100mL溶液,2Na+2H2O=2NaOH+H2↑
试计算:(1)生成的气体在标况下的体积是多少?___
(2)反应后所得溶液的物质的量浓度是多少?___
(3)在完全反应后转移的电子个数为多少?(用单线桥方法标出)___
【答案】1.12L 1mol/L 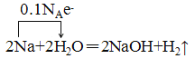
【解析】
n(Na)=![]() =0.1mol;
=0.1mol;
(1)该反应中Na失电子生成钠离子、水得电子生成氢气,根据转移电子守恒计算生成氢气体积;
(2)根据Na原子守恒得n(NaOH),再根据c=![]() 计算氢氧化钠物质的量浓度;
计算氢氧化钠物质的量浓度;
(3)根据反应中电子的转移数目和方向分析。
n(Na)=![]() =0.1mol;
=0.1mol;
(1)该反应中Na失电子生成钠离子、水得电子生成氢气,根据转移电子守恒得氢气体积=![]() ×22.4L/mol=1.12L;
×22.4L/mol=1.12L;
(2)根据Na原子守恒得n(NaOH)=n(Na)=0.1mol,c(NaOH)=
![]() =
=![]() =1mol/L;
=1mol/L;
(3)在反应2Na+2H2O=2NaOH+H2↑中Na从0价升高为+1价,则0.1molNa共失去0.1NA个电子,用单线桥表示反应中电子的转移数目和方向为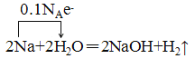 。
。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1)基态Ni原子的价电子排布式是___。
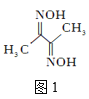
(2)丁二酮肟(结构简式如图1所示)中碳原子的杂化方式为___。丁二酮肟中C、N、O第一电离能由大到小的顺序为___。1mol丁二酮肟分子中含有σ键的数目为___mol。
(3)Ni(CO)4是一种无色液体,与CO互为等电子体的二价阴离子的电子式为___。
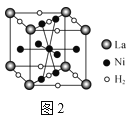
(4)图2是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1molLa的合金含有Ni的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。
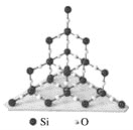
下列关于二氧化硅晶体的说法不正确的是( )
A. 晶体中每个硅原子与4个氧原子相连
B. 晶体中硅、氧原子个数比为1∶2
C. 晶体中最小环上的原子数为8
D. 晶体中共用一个硅原子的最小的环的原子数目为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的0.1 mol·L-1的盐酸中,试预测实验结果:__________与盐酸反应最剧烈,__________与盐酸反应最慢。
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_______,________________。
Ⅱ.利用下图装置可以验证非金属性的变化规律。

(3)仪器A的名称为________,干燥管D的作用是_____________________________。
(4)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________________________。
(5)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有KOH和Ca(OH)2的混合溶液,c(OH﹣)=0.1 molL﹣1。取此溶液500 mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示。图中(V1)为112 mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
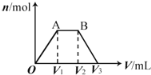
A. 560、672 B. 1008、1120 C. 2240、2352 D. 392、504
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用于航天飞行器中的一种全天候太阳能电化学电池在光照时的工作原理。下列说法正确的是
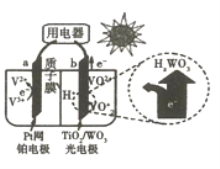
A. 该电池与硅太阳能电池供电原理相同
B. 光照时,H+由a极室通过质子膜进入b极室
C. 光照时,b极反应为VO2++2OH--e-=VO2++H2O
D. 夜间无光照时,a电极流出电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
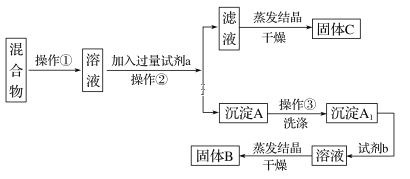
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是__________,试剂a的溶质是__________(填化学式)。
(2)加入试剂b所发生反应的化学方程式为___________________。
(3)洗涤沉淀A的方法____________________。
(4)该方案能不能达到实验目的__________,若不能,应如何改进?(若能,此问不用回答)__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题:

(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的电子式:____________________。
(2)A2B的化学式为_______________。反应②的必备条件是_______________。上图中可以循环使用的物质有_______________。
(3)在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料_______________(写化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:_______________。
(5)用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
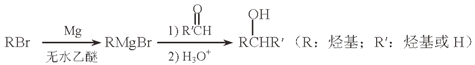
依据上述信息,写出制备![]() 所需醛的可能结构简式:_______________。
所需醛的可能结构简式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g) ![]() CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
A. 在一定条件下,使用催化剂能加快反应速率
B. 当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C. 单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D. 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com