
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
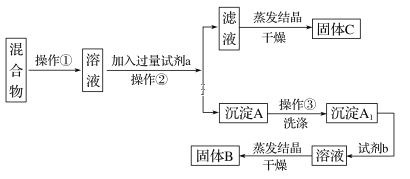
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是__________,试剂a的溶质是__________(填化学式)。
(2)加入试剂b所发生反应的化学方程式为___________________。
(3)洗涤沉淀A的方法____________________。
(4)该方案能不能达到实验目的__________,若不能,应如何改进?(若能,此问不用回答)__________________ 。
【答案】过滤 K2CO3 BaCO3+2HCl=BaCl2+CO2↑+H2O 沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复2-3次,直至洗涤干净即可(或向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复2-3次,直至洗涤干净即可) 不能 应在操作②的滤液中加入过量盐酸后再蒸发结晶
【解析】
分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后向沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸使K2CO3发生反应,可得纯净的KCl,以此解答该题。
(1)将固体溶解在水中配成溶液,向该溶液中加入过量K2CO3溶液,发生反应:K2CO3+BaCl2=BaCO3↓+2KCl,操作②为固体和液体的分离,操作名称为过滤,试剂a的溶质为K2CO3;
(2)沉淀A是BaCO3,向该沉淀中加入蒸馏水没过沉淀,对沉淀洗涤,得到沉淀A1为纯净BaCO3,然后加入稀盐酸,使沉淀发生溶解,发生反应:BaCO3+2HCl=BaCl2+CO2↑+H2O;
(3)洗涤沉淀A的方法是沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复2-3次,直至洗涤干净即可或向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复2-3次,直至洗涤干净即可;
(4)在操作②过滤得到的滤液中含有KCl和过量K2CO3,滤液为KCl和K2CO3的混合物,直接将该溶液蒸发结晶、干燥,得到的固体C是KCl和K2CO3的混合物,因此不能达到分离KCl和BaCl2两种固体混合物的目的。改进方法是在操作②的滤液中加入过量盐酸,使K2CO3与HCl发生反应:K2CO3+2HCl=2KCl+ CO2↑+H2O,然后再蒸发结晶,就可以得到纯净的KCl。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
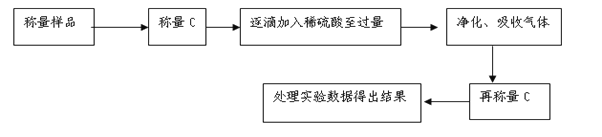
【题目】某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用气体体积测量法
(1)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用__________(以下选项中选择)使测量误差较小.

A.饱和碳酸钠溶液
B.饱和碳酸氢钠溶液
C.饱和氢氧化钠溶液
D.饱和盐酸溶液
方案Ⅱ:乙组同学的主要实验流程图如下:
按如下图所示装置进行实验:(已知:碱石灰中含有NaOH和CaO,能吸收水分和酸性气体)
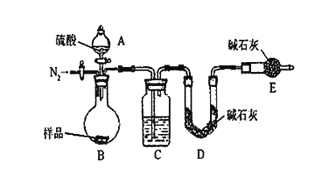
(2)在D中装碱石灰来吸收净化后的气体.E装置的作用是______________________.
(3)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是_______________________________.
方案Ⅲ:丙组同学用质量法,按如下图所示的实验流程进行实验:

(4)实验时,蒸发结晶操作中,除了酒精灯外,还要用到的玻璃仪器是________
(5)有同学认为“加入适量盐酸”不好操控,应改为“过量盐酸”,便于操作且不影响测定的准确性,为什么__________________________________
(6)若实验中测得样品质量为46.4g,固体质量为40.95g,则碳酸钠的质量分数为_____.(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3g钠跟水反应后,得到100mL溶液,2Na+2H2O=2NaOH+H2↑
试计算:(1)生成的气体在标况下的体积是多少?___
(2)反应后所得溶液的物质的量浓度是多少?___
(3)在完全反应后转移的电子个数为多少?(用单线桥方法标出)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M表示摩尔质量,NA表示阿伏加德罗常数,Vm表示气体摩尔体积,ω表示溶质的质量分数,ρ(单位为gcm-3)表示溶液的密度。下列说法中不正确的是( )
A.根据摩尔质量和阿伏加德罗常数可以计算得出某气体分子的质量:![]()
B.根据气体摩尔体积和阿伏加德罗常数可以计算得出该条件下某气体分子的大小:![]()
C.根据摩尔质量和气体摩尔体积可以计算得出该条件下某气体的密度:![]()
D.根据溶质的质量分数、摩尔质量和溶液的密度可以计算出某溶液的物质的量浓度:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
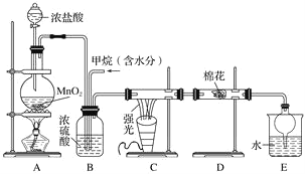
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学方程式:___________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或“不正确”)。
(2)B装置有三种功能:①控制气流速率;②混匀混合气体;③________________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1 mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为________,生成HCl的总物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:

已知:CuFeS2+3CuCl2=4CuCl+FeCl2+2S
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_____.
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为_____.
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是_____.(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有_____,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_____.
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2![]() 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2![]() 2Cu+SO2此工艺与前一工艺相比主要缺点有_____.
2Cu+SO2此工艺与前一工艺相比主要缺点有_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com