
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】金属(M)空气电池的工作原理如图所示。下列说法正确的是( )
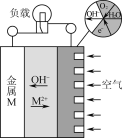
A.金属M作电池正极
B.电解质是熔融的MO
C.电路中转移2 mol电子,理论上约消耗空气56 L
D.电池总反应为2M+O2+2H2O=2M(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
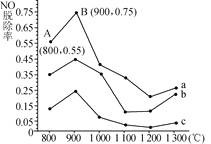
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线________(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是____________。
(3)NO氧化反应:2NO(g)+O2(g)2NO2(g)分两步进行,其反应过程能量变化示意图如图:

Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:______。

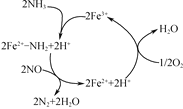
(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:

研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
(1)基态Ni原子核外的最高能层符号是______,基态Ni2+最外层电子排布式为_______,未成对电子数为________________。
(2)[Co(NO![]() )4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
)4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
(3)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如图所示:
①上述三种晶体的晶胞中属于体心立方晶胞的是______(填“α”“δ”或“γ”)-Fe。
②γ-Fe晶胞中铁原子的配位数为_______________。
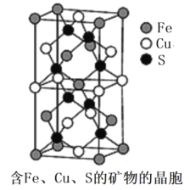
(4)一种含有Fe、Cu、S 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为Apm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________g/cm3(写出表达式)。
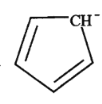
(5)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249℃,易升华,难溶于水,易溶于有机溶剂,它属于__________晶体。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H![]() )结构如图所示,其中的大π键可以表示为_______。
)结构如图所示,其中的大π键可以表示为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用CuSi合金作硅源,在950℃利用三层液熔盐进行电解精炼,下列说法正确的是( )
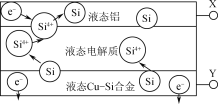
A.X与电源的正极相连
B.电子能够在三层液熔盐间自由流动
C.电子由液态CuSi合金流出
D.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
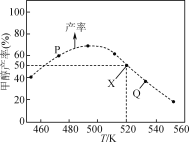
【题目】在体积为2L的恒容容器中,用CO2和H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g)。将1molCO2和3molH2在反应器中反应8小时,CH3OH的产率与温度的关系如图所示。下列说法正确的是( )
A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH>0
CH3OH(g)+H2O(g)的ΔH>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2的转化率
D.520K时,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=
CH3OH(g)+H2O(g)的平衡常数K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:

下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂的体积(V)的关系如图所示。

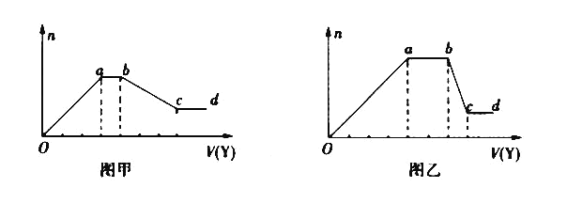
(1)若Y是盐酸,所得到的关系图如图甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是_____,ab段发生反应的离子是_________,bc段发生反应的离子方程式是_________。
(2)若Y是NaOH溶液,所得到的关系图如图乙所示,则X中一定含有的离子是__________,假设X溶液中只含这几种离子,则溶液中各离子物质的量之比为_____,ab段反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,用0.1000mol/L的NaOH溶液滴定40.00mL0.1mol/L的某二元弱酸H2R溶液,所得滴定曲线如图所示(设所得溶液体积等于两种溶液体积之和)。下列说法正确的是
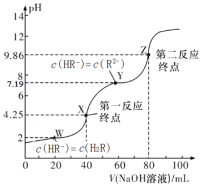
A.若只滴定到第一反应终点,可用酚酞做指示剂
B.图中Y点对应的溶液中:c(Na+)+c(H+)=2c(HR-)+c(OH-)
C.图中Z点对应的溶液中c(Na+)约为0.067mol/L,R2-的水解率大于1%
D.若pK=-lgK,2HR-![]() R2-+H2R达平衡时pK=5.19
R2-+H2R达平衡时pK=5.19
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com