
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂的体积(V)的关系如图所示。

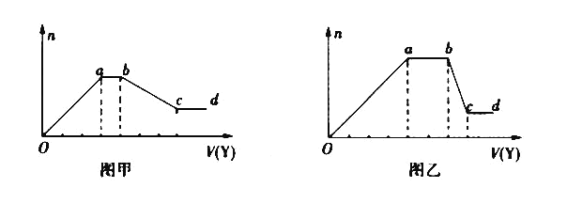
(1)若Y是盐酸,所得到的关系图如图甲所示,则oa段转化为沉淀的离子(指来源于X溶液的,下同)是_____,ab段发生反应的离子是_________,bc段发生反应的离子方程式是_________。
(2)若Y是NaOH溶液,所得到的关系图如图乙所示,则X中一定含有的离子是__________,假设X溶液中只含这几种离子,则溶液中各离子物质的量之比为_____,ab段反应的离子方程式为_____________。
【答案】SiO32—、AlO2- CO32- 3H+ +Al(OH)3 =Al3+ +3H2O Al3+ Mg2+ NH4+ Cl- 2:1:4:12 NH4++OH-═NH3H2O
【解析】
无色溶液中不可能含有Fe3+离子。
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,当a-b段时,沉淀的量不变化,盐酸和碳酸根离子反应生成气体,则溶液中不含镁离子、铝离子;当b-c段时沉淀的质量减少,部分沉淀和盐酸反应,部分沉淀和盐酸不反应,说明溶液中有硅酸根离子和偏铝酸根离子,弱酸根离子和铵根离子能双水解,所以溶液中含有的阳离子是钠离子;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,当a-b段时,沉淀的量不变化,氢氧化钠和铵根离子反应生成气体;当b-c段时沉淀的质量减少,部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有铝根离子和镁离子,则溶液中不含硅酸根离子、碳酸根离子和偏铝酸根离子,所以溶液中含有的阴离子是氯离子。
(1)如果Y是盐酸,由图可知,向溶液中加盐酸,先生成沉淀后沉淀部分溶解,则溶液中可能含SiO32-、AlO2-,不含Al3+、Mg2+;ab段,沉淀的量没有变化,说明溶液中含有CO32-,盐酸和碳酸根离子反应,反应的离子方程式依次为CO32-+H+═HCO3-和HCO3-+H+═H2O+CO2↑;bc段,氢氧化铝沉淀与盐酸反应生成偏铝酸钠和水,硅酸沉淀不反应,沉淀部分溶解,反应的离子方程式为3H+ +Al(OH)3 =Al3+ +3H2O,故答案为:SiO32—、AlO2—;CO32-;3H+ +Al(OH)3 =Al3+ +3H2O;
(2)若Y是氢氧化钠,由图可知,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸的阴离子会双水解而不能共存,即溶液中不含CO32-、SiO32-、AlO2-,由于溶液一定要保持电中性,故溶液中一定含Cl-;ab段,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH-═NH3H2O,即溶液中含NH4+;bc段,沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,bc段的反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-;由于溶液中有Al3+、Mg2+,oa段转化为沉淀的离子是Al3+、Mg2+,ab段是氢氧化钠和铵根离子反应生成气体,反应的离子方程式为NH4++OH-═NH3H2O;溶液中有Al3+、Mg2+,即沉淀中含Al(OH)3和Mg(OH)2,故bc段的反应离子方程式为Al(OH)3+OH-═AlO2-+2H2O,NH4+反应需要NaOH的体积是2V,由于Al(OH)3溶解时需要的NaOH的体积是V,则生成Al(OH)3需要的NaOH的体积是3V,而生成Mg(OH)2和Al(OH)3共消耗NaOH的体积为4V,则生成Mg(OH)2需要NaOH溶液的体积是V,则n(Al3+):n(Mg2+):n(NH4+)=2:1:4,根据溶液要呈电中性,即有:3n(Al3+)+2n(Mg2+)+n(NH4+)=n(Cl-),故n(Cl-)=12,即有:n(Al3+):n(Mg2+):n(NH4+):n(Cl-)=2:1:4:12,故答案为:Al3+、Mg2+、NH4+、Cl-;2:1:4:12;NH4++OH-═NH3H2O。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,

写出A、B、C、D、E、F的化学式: A.____,B.____,C._____,D._____,E._____,F.______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CP是一种起爆药,化学式为[Co(NH3)5(C2N5)](ClO4)2。CP可由5-氰基四唑(分子式为HC2N5,结构简式如图1所示)和[Co(NH3)5(H2O)](ClO4)3反应制备。
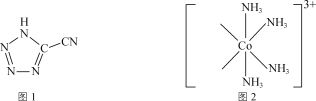
(1)CP中Co3+基态电子排布式为___。
(2)5-氰基四唑中C原子的杂化类型为__,所含C、N元素的电负性的大小关系为C__(填“>”“=”或“<”)N。1mol5-氰基四唑中含有σ键的数目为__。
(3)[Co(NH3)5(H2O)](ClO4)3中的配离子部分结构如图2所示。
①请在相应位置补填缺少的配体___。
②与NH3互为等电子体的一种阳离子为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物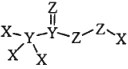 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素。下列叙述正确的是
A.原子半径:X>Y>Z
B.元素的非金属性:X<Y<Z
C.该化合物中Z的化合价均呈-2 价
D.该化合物中 X、Y、Z都满足 8 电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A. 碳与热的浓硫酸反应的化学方程式:C+2H2SO4(浓)![]() CO↑+2SO2↑+2H2O
CO↑+2SO2↑+2H2O
B. 乙炔燃烧的化学方程式:2C2H2 +5O2 ![]() 4CO2 +2H2O
4CO2 +2H2O
C. 氯化氢在水中的电离方程式:HCl=H+ +Cl-
D. 氯化铵水解的离子方程式:NH4++H2O ![]() NH3·H2O+H+
NH3·H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列有关叙述正确的是( )
①1mol苯乙烯中含有的碳碳双键数为4NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N—H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
A. ①④⑦ B. ②⑤⑧ C. ②③④⑥ D. ①②④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com