
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
(1)基态Ni原子核外的最高能层符号是______,基态Ni2+最外层电子排布式为_______,未成对电子数为________________。
(2)[Co(NO![]() )4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
)4]2–中各元素的第一电离能由小到大的顺序为______(填元素符号),配体中N的杂化方式为______________。
(3)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如图所示:
①上述三种晶体的晶胞中属于体心立方晶胞的是______(填“α”“δ”或“γ”)-Fe。
②γ-Fe晶胞中铁原子的配位数为_______________。
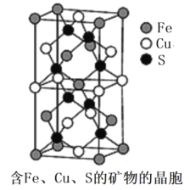
(4)一种含有Fe、Cu、S 三种元素的矿物的晶胞(如图所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________。若晶胞的底面边长为Apm,高为C pm,阿伏伽德罗常数为NA,则该晶体的密度为__________g/cm3(写出表达式)。
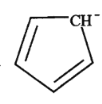
(5)二茂铁[(C5H5)2Fe]可用作火箭燃料添加剂、汽油抗爆剂。二茂铁熔点172℃,沸点249℃,易升华,难溶于水,易溶于有机溶剂,它属于__________晶体。分子中的大π键可用符号![]() 表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,环戊二烯负离子(C5H![]() )结构如图所示,其中的大π键可以表示为_______。
)结构如图所示,其中的大π键可以表示为_______。
【答案】N 3s23p63d8 2 Co、O、N sp2杂化 δ 12 FeCuS2(或CuFeS2) ![]() 或
或![]() 分子
分子 ![]()
【解析】
(1)根据元素符号,判断元素原子的核外电子数,根据构造原理写出该元素离子的最外层电子排布式。
(2)根据电离能的变化规律进行判断,但不要忘记特殊情况。
(3)分析晶体结构,结合常见的晶体结构模型进行分析判断。
(4)利用均摊法计算晶胞拥有的粒子数目,根据公式![]() 求算晶胞的密度。
求算晶胞的密度。
(5)根据晶体的特征性质判断晶体类型。分析环戊二烯负离子,碳原子均与3个原子相邻,故均取sp2杂化,杂化轨道互相重叠,形成分子的σ键,使所有原子处于同一个平面,每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里有一个电子,再加上该体系带有一个单位负电荷,具备了形成大π键的条件,据题意可表示出该符号。
(1)Ni是30号元素,核外电子排布式为:1s22s22p63s23p63d84s2,最高能层的符号为:N;基态失去最外层两个电子变为Ni2+,基态Ni2+最外层电子排布式为:3s23p63d8;未成对电子数为2;答案为:N;3s23p63d8;2;
(2)一般情况下非金属性越强第一电离能就越大,但由于N原子中最外层为半充满状态,比较稳定,故第一电离能大于O,所以第一电离能由小到大的顺序为:Co、O、N;NO3-中价层电子对数为![]() ,故为sp2杂化;答案为:Co、O、N;sp2杂化;
,故为sp2杂化;答案为:Co、O、N;sp2杂化;
(3)①根据晶胞结构图,三种晶体的晶胞中属于体心立方晶胞的是δ;答案为:δ;
②γ-Fe晶体晶胞类型为面心立方,位于顶点的Fe原子,被晶胞的三个平面共有,每个平面与其距离相等的Fe原子数目为4,则共有![]() ,故配位数为12;答案为:12;
,故配位数为12;答案为:12;
(4)根据均摊法可知,1个晶胞中含Cu原子个数为:![]() ,Fe原子数为:
,Fe原子数为:![]() ,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞体积为
,S原子数为:8,故此矿物的化学式为:FeCuS2(或CuFeS2);晶胞体积为![]() ,1个晶胞的质量为
,1个晶胞的质量为![]() ,则密度
,则密度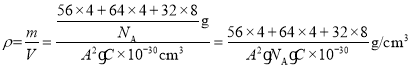 或
或![]() ,答案为:FeCuS2(或CuFeS2);
,答案为:FeCuS2(或CuFeS2);![]() 或
或![]() ;
;
(5)二茂铁晶体熔沸点不高,易升华,易溶于有机溶剂,符合分子晶体特征,所以该晶体为分子晶体;由环戊二烯负离子(C5H5–)结构图可知,环戊二烯负离子,由两个双键和一个负电荷组成环状共轭体系,π电子数是6,即形成5个碳原子、6个π电子的大π键,符号为![]() ;答案为:分子;
;答案为:分子;![]() 。
。


科目:高中化学 来源: 题型:
【题目】化学与生活生产密切相关。下列说法中不正确的是
A. 施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
B. 夏天冰箱保鲜食品的原理是降低温度,减小化学反应速率
C. 施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D. 将海水直接电解可获得 Mg及Cl2等单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,

写出A、B、C、D、E、F的化学式: A.____,B.____,C._____,D._____,E._____,F.______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述错误的是
A.100g 9.8%的硫酸与磷酸的混合溶液中含氧原子数为0.4NA
B.向100mL0.1 mol/L 醋酸溶液中加入CH3COONa固体至溶液刚好为中性,溶液中醋酸分子数为0.01NA
C.等物质的量的甲基(-CH3)和羟基(-OH)所含电子数相等
D.含2.8g硅的SiO2晶体中存在的共价键总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以电镀废渣(Cr2O3、CuO、Fe2O3及CaO)为原料制取铜粉和K2Cr2O7的主要流程如图:
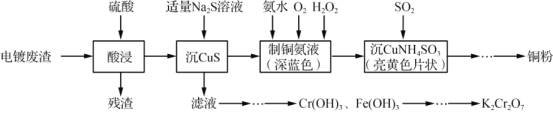
(1)“酸浸”时,所得残渣的主要成分是___________。
(2)“沉 CuS”时,加入的硫化钠必须适量,若过量可能产生的后果是_________(用离子方程式表示)。
(3)一水合硫酸四氨合铜加热到650℃可分解为铜、氨气、二氧化硫和水以及一种无污染气体,写出其化学方程式___________。
(4)“沉CuNH4 SO3”时可用如图装置(夹持、加热仪器略):
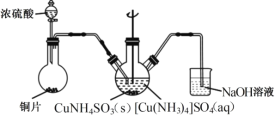
①“沉CuNH4SO3”时,反应液需控制在45℃,合适的加热方式是____________。
②NaOH溶液的作用是___________。
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.0g配成250 mL溶液,用移液管取出25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L–1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O72-被还原为Cr3+)
①若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品K2Cr2O7的纯度为_____%。[已知M(K2Cr2O7)=294g·mol-1,计算结果保留至小数点后两位]。
②上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的 Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=2×10–5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?____________(通过计算说明原因)。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像与描述相符的是( )
A.图1是C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0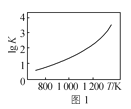
B.图2表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化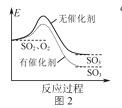
C.图3是室温下AgCl和AgI的饱和溶液中离子浓度的关系曲线,说明该温度下反应AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=2.5×106
AgI(s)+Cl-(aq)的平衡常数K=2.5×106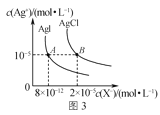
D.图4表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化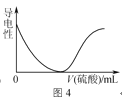
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CP是一种起爆药,化学式为[Co(NH3)5(C2N5)](ClO4)2。CP可由5-氰基四唑(分子式为HC2N5,结构简式如图1所示)和[Co(NH3)5(H2O)](ClO4)3反应制备。
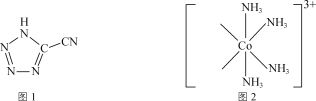
(1)CP中Co3+基态电子排布式为___。
(2)5-氰基四唑中C原子的杂化类型为__,所含C、N元素的电负性的大小关系为C__(填“>”“=”或“<”)N。1mol5-氰基四唑中含有σ键的数目为__。
(3)[Co(NH3)5(H2O)](ClO4)3中的配离子部分结构如图2所示。
①请在相应位置补填缺少的配体___。
②与NH3互为等电子体的一种阳离子为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com