
����Ŀ���Ӻ�ͭ�ḻ����Ȼ��Դ��ͭ��CuFeS2��ұ��ͭ�Ĺ����������£�

��֪��CuFeS2+3CuCl2��4CuCl+FeCl2+2S
��1����ȡʱ��������FeCl3��Һ��Ҳ������CuCl��S���÷�Ӧ��ѧ����ʽΪ_____��
��2��������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ����ù���Ļ�ѧʽΪ_____��
��3��������Һ��pH������Cu�⣬���ܲ���һ�ֽ������ӣ��˽���������_____���������ӷ��ţ�
��4������3������Һ�п���ѭ��ʹ�õ�������_____��Ϊ�������̳���ѭ����ÿ����1molCu���������貹��CuCl2�����ʵ���Ϊ_____��
��5��ұ�����ջ����Խ���ѡ��Ļ�ͭ��ɰ������ڸ��������գ�ʹ��ת��Ϊͭ����ѧ����ʽΪ��6CuFeS2+13O2![]() 3Cu2S+2Fe3O4+9SO2��Cu2S+O2
3Cu2S+2Fe3O4+9SO2��Cu2S+O2![]() 2Cu+SO2�˹�����ǰһ���������Ҫȱ����_____��
2Cu+SO2�˹�����ǰһ���������Ҫȱ����_____��
���𰸡�CuFeS2+ 3FeCl3��CuCl + 4FeCl2+ 2S Fe2O3 Cu2+ CuCl2��HCl�� 0.5mol �������Ⱦ����������SO2���ܺĸߵ�
��������
CuFeS2����CuCl2��ȡ����CuFeS2+3CuCl2��4CuCl+FeCl2+2S�����˺�õ���Һ����FeCl2�����庬��CuCl��S��������������˵õ���Һ����[CuCl2]����������ҺpH�����绯��Ӧ����Cu��Cu2+�����˿ɵõ�Cu���õ���Һ����Cu2+���Դ˽����⡣
CuFeS2����CuCl2��ȡ����CuFeS2+3CuCl2��4CuCl+FeCl2+2S�����˺�õ���Һ����FeCl2�����庬��CuCl��S��������������˵õ���Һ����[CuCl2]����������ҺpH�����绯��Ӧ����Cu��Cu2+�����˿ɵõ�Cu���õ���Һ����Cu2+��
��1��CuFeS2��3FeCl3֮�䷢������������ԭ��Ӧ����ѧ����ʽΪ��CuFeS2+3FeCl3��CuCl+4FeCl2+2S���ʴ�Ϊ��CuFeS2 + 3FeCl3��CuCl + 4FeCl2 + 2S��
��2������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ���ˮ�����������������������������������������������������������շֽ����������������ù���ΪFe2O3���ʴ�Ϊ��Fe2O3��
��3�����˵õ���Һ����[CuCl2]����������ҺpH�����绯��Ӧ����Cu��Cu2+���ʴ�Ϊ��Cu2+��
��4����3������Һ�к���HCl��CuCl2������ѭ��ʹ�ã��漰��Ӧ��CuFeS2+3CuCl2��4CuCl+FeCl2+2S��2CuCl��Cu+CuCl2���ۺ�������ѧ����ʽ�ɵ�CuFeS2+CuCl2��2Cu+FeCl2+2S���ɷ���ʽ�ɵ�ÿ����1molCu���������貹��CuCl2�����ʵ���Ϊ0.5mol��
�ʴ�Ϊ��CuCl2(HCl)��0.5mol��
��5������ѡ��Ļ�ͭ��ɰ������ڸ��������գ�ʹ��ת��Ϊͭ�����ɶ����������壬��Ⱦ���������ܺĸߣ��ʴ�Ϊ���������Ⱦ����������SO2���ܺĸߵȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������辧�����������״�ṹ����ṹ��ͼ��ʾ��
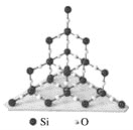
���й��ڶ������辧���˵������ȷ����(����)
A. ������ÿ����ԭ����4����ԭ������
B. �����й衢��ԭ�Ӹ�����Ϊ1��2
C. ��������С���ϵ�ԭ����Ϊ8
D. �����й���һ����ԭ�ӵ���С�Ļ���ԭ����ĿΪ12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���KCl��BaCl2���ֹ�������Իش��������⣺
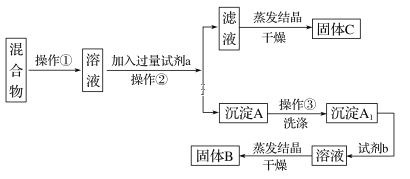
��ѡ�Լ���Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ������
(1)�����ڵ�������__________���Լ�a��������__________(�ѧʽ)��
(2)�����Լ�b��������Ӧ�Ļ�ѧ����ʽΪ___________________��
(3)ϴ�ӳ���A�ķ���____________________��
(4)�÷����ܲ��ܴﵽʵ��Ŀ��__________�������ܣ�Ӧ��θĽ���(���ܣ����ʲ��ûش�)__________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�з�Ӧ�����Ʊ�SiH4��һ�ַ������丱����MgCl2��6NH3�����ʵ�þ��Դ���ش��������⣺

��1��MgCl2��6NH3����Ԫ�صļ����Ӱ뾶��С�����˳��H-���⣩��_________________________��Mg��Ԫ�����ڱ��е�λ�ã�_____________________��Mg(OH)2�ĵ���ʽ��____________________��
��2��A2B�Ļ�ѧʽΪ_______________����Ӧ�ڵıر�������_______________����ͼ�п���ѭ��ʹ�õ�������_______________��
��3����һ�������£���SiH4��CH4��Ӧ����H2��һ�ֹ�����ĥ����_______________��д��ѧʽ����
��4��Ϊʵ��ȼú������ú�м��뽬״Mg(OH)2��ʹȼ�ղ�����SO2ת��Ϊ�ȶ���Mg�����д���÷�Ӧ�Ļ�ѧ����ʽ��_______________��
��5����Mg�Ƴɵĸ����Լ���RMgBr���������л��ϳɣ������Ʊ��������ĺϳ�·�����£�
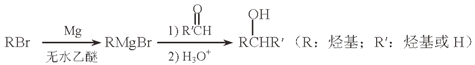
����������Ϣ��д���Ʊ�![]() ����ȩ�Ŀ��ܽṹ��ʽ��_______________��
����ȩ�Ŀ��ܽṹ��ʽ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.1molL��1 NaOH��Һ����20mL0.1molL��1CH3COOH��Һ�У���������Һ�������V���ͻ��Һ��pH��ϵ������ͼ��ʾ�����н�����ȷ���ǣ�������
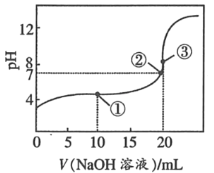
A.�ٵ�ʱ��c��CH3COO����+c��CH3COOH����c��Na+��
B.�������Ϣ٢ڢ��κ�һ�㣬��Һ�ж���c��Na+��+c��H+����c��OH����+c��CH3COO����
C.�۵�ʱ������ǡ����ȫ��Ӧ����Һ����c��CH3COO������c��Na+����c��H+����c��OH����
D.�ζ������п��ܳ���c��H+����c��Na+����c��CH3COO������c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ�Ⱦ�Ϊ3mol��L��1��H2SO4��NaOH��Һ��100 mL�У��ֱ��������������ۣ���Ӧ��Ϻ����������������Ϊ4��5����������۵����ʵ���Ϊ�� ��
A.0.125molB.0.25molC.0.5molD.1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������γɶ��ֻ������Fe��SCN��3��[Fe��CO��5]���ʻ������������������������й㷺Ӧ�á�
��1��Fe3+��̬��������Ų�ʽΪ_____��
��2��ʵ������KSCN��Һ��������Һ����Fe3+��N��O��S�ĵ�һ�������ɴ�С��˳��Ϊ____����SCN���е�̼ԭ�ӵ��ӻ��������Ϊ_____����SCN����Ϊ�ȵ�����ķ�����_____��
��3���ʻ���[Fe��CO��5]������������1mol[Fe��CO��5]�����к�������ĿΪ_____��
��4��ij�ֵ����������ľ�����ͼ��ʾ���õ���������Ļ�ѧʽΪ_____��
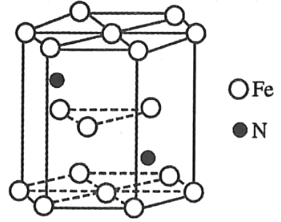
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��COCl2�����������������ж����塣��һ�������£��ɷ����Ļ�ѧ��ӦΪ��COCl2(g) ![]() CO(g)��Cl2(g)����H<0 �����й�˵������ȷ����
CO(g)��Cl2(g)����H<0 �����й�˵������ȷ����
A. ��һ�������£�ʹ�ô����ܼӿ췴Ӧ����
B. ����Ӧ��ƽ��ʱ�����º�ѹ������ͨ��Ar��COCl2��ת���ʲ���
C. ��λʱ��������CO������Cl2�����ʵ�����Ϊ1��1ʱ����Ӧ�ﵽƽ��״̬
D. ƽ��ʱ�������������䣬�����¶ȿ�ʹ�÷�Ӧ��ƽ�ⳣ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼ����ؿ���������������Ĺ�����Դ��һ���ȼ����صĻ����ṹ��ͼ��ʾ��������Ϊ����ʵ���ˮLiCl-KCl������������ں�ؼ���˲��������ܡ��õ���ܷ�ӦΪ��PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb�������й�˵����ȷ����

A. ������Ӧʽ��Ca + 2Cl����2e�� = CaCl2
B. �ŵ�����У�Li+���ƶ�
C. ûת��0.1mol���ӣ�����������20.7 g Pb
D. ����ʱ��������������ϵ�����������ƣ�ָ�벻ƫת
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com