
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.在容积不变的反应器中,化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示
C.若某化学反应的反应速率为![]() ,就是指在该时间内反应物和生成物的浓度变化都为
,就是指在该时间内反应物和生成物的浓度变化都为![]()
D.化学反应速率是可以通过实验测定的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化工生产原理正确的是
A. 工业制取烧碱:Na2O+H2O=2NaOH
B. 工业合成盐酸:H2+Cl2![]() 2HCl
2HCl
C. 工业制取乙烯:C2H5OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
D. 工业制漂粉精:2Ca(OH)2+2Cl2 =Ca(ClO)2+CaCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,下列说法正确的是
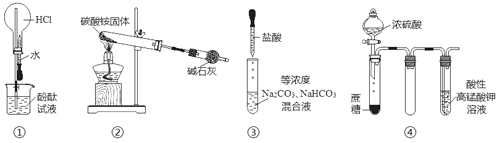
A. 实验①可观察到红色喷泉
B. 实验②可收集到少量氨气
C. 实验③中逐滴滴加稀盐酸时,试管中立即产生大量气泡
D. 实验④中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石。晶体硅(熔点1410℃)用途广泛,制取与提纯方法有多种。
(1)炼钢开始和结束阶段都可能发生反应: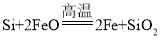 ,其目的是________。
,其目的是________。
A.得到副产品硅酸盐水泥 B.制取SiO2,提升钢的硬度
C.除去生铁中过多的Si杂质 D.除过量FeO,防止钢变脆
(2)一种由粗硅制纯硅过程如下:![]() 在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______。对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是(_________)
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______。对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是(_________)
A.NaX易水解 B.SiX4是共价化合物
C.NaX的熔点一般高于SiX4 D.SiF4晶体是由共价键形成的空间网状结构
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解也可以生成高纯硅。硅烷的热稳定性弱于甲烷, 所以Si元素的非金属性弱于C元素,用原子结构解释其原因:_______。
(4)此外,还可以将粗硅转化成三氯氢硅(SiHCl3),通过反应:SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)制得高纯硅。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是(__________)(填字母序号)。
Si(s)+3HCl(g)制得高纯硅。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是(__________)(填字母序号)。
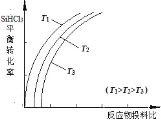
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
c.实际生产中为提高SiHCl3的利用率,可适当降低压强
(5)硅元素最高价氧化物对应的水化物是H2SiO3。室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是_______,其原因是_______。
已知:H2SiO3:Ki1=2.0×10-10,Ki2=1.0×10-12;H2CO3:Ki1=4.3×10-7,Ki2=5.6×10-11。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在一定条件下转化为金刚石,其能量变化如图所示,其中ΔE1=393.5 kJ,ΔE2=395.4 kJ,下列说法正确的是

A. 1 mol石墨完全转化为金刚石需吸收1.9 kJ的能量
B. 石墨转化为金刚石属于物理变化
C. 金刚石的稳定性强于石墨的
D. 1 mol金刚石的能量大于1 mol CO2的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用滴有酚酞和氯化钠溶液湿润的滤纸分别做甲、乙两个实验,下列判断错误的是( )

A.b极附近有气泡冒出B.d极附近出现红色
C.a、c极上都发生氧化反应D.甲中铁棒比乙中铁棒更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 25 mL 1.00 mol/L HCl 溶液中逐滴加入未知浓度 NaOH 溶液 V mL,将溶液搅拌均匀后,在保温隔热的条件下测量并记录混合溶液的温度,实验结果如图所示。下列叙述正确的是
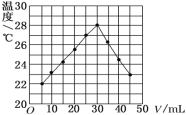
A.做该实验时环境温度为22℃
B.加入30 mLNaOH 溶液时,HCl完全被中和
C.NaOH 溶液的物质的量浓度约为1.0 mol/L
D.该实验表明热能可能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com