
����Ŀ������Ԫ�صĻ�����㷺��������Ȼ���У����������ﹲͬ������ʯ�������(�۵�1410��)��;�㷺����ȡ���ᴿ�����ж��֡�
(1)���ֿ�ʼ�ͽ����ζ����ܷ�����Ӧ��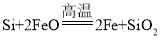 ����Ŀ����________��
����Ŀ����________��
A.�õ�����Ʒ������ˮ�� B.��ȡSiO2�������ֵ�Ӳ��
C.��ȥ�����й����Si���� D.������FeO����ֹ�ֱ��
(2)һ���ɴֹ��ƴ���������£�![]() ��������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12kg����������akJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��_______�������Ƶ�±����(NaX)���±����(SiX4)����������ȷ������_________��
��������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12kg����������akJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��_______�������Ƶ�±����(NaX)���±����(SiX4)����������ȷ������_________��
A.NaX��ˮ�� B.SiX4�ǹ��ۻ�����
C.NaX���۵�һ�����SiX4 D.SiF4�������ɹ��ۼ��γɵĿռ���״�ṹ
(3)�ֹ辭ϵ�з�Ӧ�����ɹ���(SiH4)������ֽ�Ҳ�������ɸߴ��衣��������ȶ������ڼ��飬 ����SiԪ�صķǽ���������CԪ�أ���ԭ�ӽṹ������ԭ��_______��
(4)���⣬�����Խ��ֹ�ת�����������(SiHCl3)��ͨ����Ӧ��SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)�Ƶøߴ��衣��ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ������Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ������__________��������ĸ��ţ���
Si(s)+3HCl(g)�Ƶøߴ��衣��ͬ�¶��£�SiHCl3��ƽ��ת�����淴Ӧ���Ͷ�ϱȣ���Ӧ��ʼʱ������Ӧ������ʵ���֮�ȣ��ı仯��ϵ��ͼ��ʾ������˵����ȷ������__________��������ĸ��ţ���
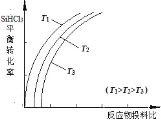
a.�÷�Ӧ��ƽ�ⳣ�����¶����߶�����
b.�������ʾ��Ͷ�ϱ�Ӧ����![]()
c.ʵ��������Ϊ���SiHCl3�������ʣ����ʵ�����ѹǿ
(5)��Ԫ������������Ӧ��ˮ������H2SiO3�������£�0.1mol/L�Ĺ�������Һ��0.1mol/L��̼������Һ�����Ը�ǿ����_______����ԭ����_______��
��֪��H2SiO3��Ki1=2.0��10-10��Ki2=1.0��10-12��H2CO3��Ki1=4.3��10-7��Ki2=5.6��10-11��
���𰸡�CD 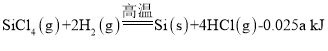 BC C��Si������������ͬ��������ͬ����Ԫ��������Cԭ�Ӱ뾶С��Si������Cԭ�ӵ��Ӳ�������Si���� a��c ������ �����Ki2С��̼���Ki2�������Ƹ���ˮ��
BC C��Si������������ͬ��������ͬ����Ԫ��������Cԭ�Ӱ뾶С��Si������Cԭ�ӵ��Ӳ�������Si���� a��c ������ �����Ki2С��̼���Ki2�������Ƹ���ˮ��
��������
(1)�������ֵ�Ҫ��������еĺ�̼����ȥ���涨��Χ����ʹ����Ԫ�صĺ������ٻ����ӵ��涨��Χ�Ĺ��̣���˵���Ƕ�������̼��ȥ���ס������̺����Ĺ��̣���ʹ̼��Ԫ�ؽ����涨��Χ��ˮ���Ժ��д�������Ԫ�أ����к������ʣ�ʹ�����Ա仵������ʱ�ײ������ƣ�
(2)ÿ����1.12kg����������a kJ������������1mol�������յ�����Ϊ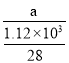 =0.025a kJ���ݴ�д����Ӧ�Ȼ�ѧ����ʽ��
=0.025a kJ���ݴ�д����Ӧ�Ȼ�ѧ����ʽ��
A.ǿ������β�ˮ�⣻
B.���±����(SiX4)���ɷǽ���Ԫ��ԭ�Ӽ�ͨ�����õ��Ӷ��γɵĻ����
C.���Ӿ�����۵���ڷ��Ӿ�����۵㣻
D.SiF4�������ڷ��Ӿ��壻
(3)����ķֽ��¶�Զ���ڼ����ԭ��Ϊ��C��Si������������ͬ��������ͬ����Ԫ��������Cԭ�Ӱ뾶С��Si������Cԭ�ӵ��Ӳ�������Si����
SiԪ�صķǽ���������CԪ�أ���������ȶ������ڼ��飻
(4)a.��Ϊ�����¶ȵ����ߣ�SiHCl3��ת��������ƽ�����ƣ���÷�Ӧ��ƽ�ⳣ�����¶����߶�����
b.����һ�ַ�Ӧ���Ũ�ȣ������������Ӧ���ת���ʣ���������ת���ʷ������ͣ��ʺ������ʾ��Ͷ�ϱ�Ӧ����![]() ��
��
c.����ѹǿƽ��������ϵ����С�����ƶ���
(5)��������ˮ�������Խ��Խˮ�������
(1)���ֵ�Ҫ��������еĺ�̼����ȥ���涨��Χ����ʹ����Ԫ�صĺ������ٻ����ӵ��涨��Χ�Ĺ��̣���˵���Ƕ�������̼��ȥ���ס������̺����Ĺ��̣���һ���̻�������һ���������̣����ò�ͬ��Դ����(������е�����������������ʯ�е���)��������ˮ�е�̼���衢�̵�Ԫ�أ���ѧ��Ӧ��Ҫ��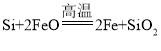 ��
�� ����ʹ̼��Ԫ�ؽ����涨��Χ��ˮ���Ժ��д������������к������ʣ�ʹ�����Ա仵������ʱ�ײ������ƣ������ֵ����α���������������������������������ȣ����Գ�ȥ��Һ�ж��������
����ʹ̼��Ԫ�ؽ����涨��Χ��ˮ���Ժ��д������������к������ʣ�ʹ�����Ա仵������ʱ�ײ������ƣ������ֵ����α���������������������������������ȣ����Գ�ȥ��Һ�ж�������� ��
��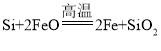 ��
��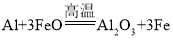 ��
��
�ʺ���ѡ����CD��
(2)�������֪��ÿ����1.12kg����������akJ������������1mol�������յ�����Ϊ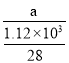 =0.025a kJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽ��
=0.025a kJ�����Ը÷�Ӧ���Ȼ�ѧ����ʽ��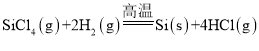 ��H= -0.025a kJ/mol��
��H= -0.025a kJ/mol��
A.�Ƶ�ǿ���β�ˮ�⣬NaX(NaF����)����ˮ�⣬A����
B.���±���SiX4�����ɷǽ���Ԫ��ԭ�Ӽ�ͨ�����õ��Ӷ��γɵĻ�����ǹ��ۻ����B��ȷ��
C.�Ƶ�±����(NaX)Ϊ���ӻ������������Ӿ��壬���±����(SiX4)Ϊ���ۻ��������ڷ��Ӿ��壬���Ӿ�����۵���ڷ��Ӿ�����۵㣬��NaX���۵�һ�����SiX4��C��ȷ��
D.SiF4�������ɷ��Ӽ���������϶��ɣ�D����
�ʺ���ѡ����BC��
(3)C��Si������������ͬ(������ͬ����Ԫ����)��Cԭ�Ӱ뾶С��Si������Cԭ�ӵ��Ӳ�������Si���� SiԪ�صķǽ���������CԪ�أ���������ȶ������ڼ��飬�ʹ���ķֽ��¶�Զ���ڼ��飻
(4)a.��Ϊ�����¶ȵ����ߣ�SiHCl3��ת��������˵�������¶ȣ���ѧƽ�������ƶ�����÷�Ӧ��ƽ�ⳣ�����¶����߶�����a��ȷ��
b.����һ�ַ�Ӧ���Ũ�ȣ������������Ӧ���ת���ʣ���������ת���ʷ������ͣ��ʺ������ʾ��Ͷ�ϱ�Ӧ����![]() ��b����
��b����
c.SiHCl3(g)+H2(g)Si(s)+3HCl(g)������Ӧ����Ϊ����ϵ����������ѹǿƽ��������ϵ�����������Ӧ�����ƶ����������SiHCl3�������ʣ�c��ȷ��
�ʺ���ѡ����a��c��
(5)�����������ݿ�֪�������Ki2С��̼���Ki2��������Խ��Խˮ������֪�����Ƹ���ˮ�⡣


 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д� Ӧ����㲦ϵ�д�
Ӧ����㲦ϵ�д� ״Ԫ����ϵ�д�
״Ԫ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A�ķ���ʽΪC8H8O2��A������ֻ��һ�������ұ�����ֻ��һ��ȡ�������������ͺ˴Ź���������ͼ�����й���A��˵���в���ȷ���ǣ� ��
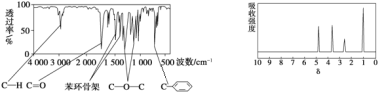
A. ��A����ͬ������ͬ���칹��ֻ��3��
B. ��������A���ӽṹ�������л���ֻ��1��
C. A��һ�������¿���3molH2�����ӳɷ�Ӧ
D. A����������������һ���������ܷ���ˮ�ⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ͭ������ĩƽ���ֳ����ȷݣ��ֱ���뵽ͬŨ�ȡ���ͬ�����ϡ�����У���ַ�Ӧ���ռ���NO����������ʣ������������� ���跴Ӧǰ����Һ��������䣬��������ѻ���Ϊ��״��ʱ���������
ʵ����� | ϡ��������/mL | ʣ����������/g | NO�����/L |
1 | 100 | 17.2 | 2.24 |
2 | 200 | 8.00 | 4.48 |
3 | 400 | 0 | V |
����˵����ȷ���ǣ�������
A. ����V=7.84 L
B. ԭ������ĩ������Ϊ25.6 g
C. ԭ������δ������ͭ�����ʵ���֮��Ϊ2��3
D. ʵ��3������Һ����������ʵ���Ũ��Ϊ0.875 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����24.0gNaOH��������ˮ���100mL��Һ�����ܶ�Ϊ1.20g�qmL-1���Լ��㣺.
(1)����Һ��NaOH�����ʵ���Ũ��Ϊ______��
(2)����Һ��NaOH����������Ϊ______����
(3)�Ӹ���Һ��ȡ��10mL�����к�NaOH������Ϊ___��
(4)��ȡ����10mL��Һ��ˮϡ�͵�100mL��ϡ�ͺ���Һ��NaOH�����ʵ���Ũ��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼ����ؿ���������������Ĺ�����Դ��һ���ȼ����صĻ����ṹ��ͼ��ʾ��������Ϊ����ʵ���ˮLiCl-KCl������������ں�ؼ���˲��������ܡ��õ���ܷ�ӦΪ��PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb�������й�˵����ȷ����

A. ������Ӧʽ��Ca + 2Cl����2e�� = CaCl2
B. �ŵ�����У�Li+���ƶ�
C. ûת��0.1mol���ӣ�����������20.7 g Pb
D. ����ʱ��������������ϵ�����������ƣ�ָ�벻ƫת
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����Mg(NO3)2Ϊ�о�������ͨ��ʵ�����̽���������ȷֽ�Ĺ��ɡ�
��������룩С���������4�ֲ��룺
�ף�Mg(NO2)2��NO2��O2 �ң�MgO��NO2��O2
����Mg3N2��O2 ����MgO��NO2��N2
(1)�������ϵ�֪��NO2�ɱ�NaOH��Һ���գ���Ӧ�Ļ�ѧ����ʽΪ��_________��
(2)ʵ��ǰ��С���Ա�������϶����붡��������������________��
��ʵ�������
(3)�����ͼװ�ã��õ����ž�װ���п�������Ŀ����_______������Mg(NO3)2���壬ABװ��ʵ�������ǣ�________��˵����Mg(NO3)2����ֽ��ˣ���NO2���ɡ�

(4)��ͬѧ�����������������Һ�����Ƿ���������������ͨ��֮ǰ��������BDװ�ü����ӵ��з�̪������������Һ���������ǣ�_______��
(5)С�����ۺ���Ϊ����ͨ��C��������������������������Һ��Ȼ���Լ��飬��Ϊ��______���Ľ��Ĵ�ʩ�ǿ�������������Һ�м���_______��
(6)����ϵ�иĽ�������ֽ��������O2���ڣ��ų�װ���������ԭ��δ����ԭ����______�����û�ѧ����ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ص��ʼ��仯�����й㷺��;����������ڱ��е�������Ԫ�����֪ʶ�ش��������⣺
(1)��ԭ������������˳��ϡ��������⣩������˵����ȷ����______��
a��ԭ�Ӱ뾶�����Ӱ뾶����С
b�������Լ������ǽ�������ǿ
c�����ʵ��۵㽵��
d���������Ӧ��ˮ������Լ�����������ǿ
ԭ�������������������������ͬ��Ԫ������Ϊ_____�������������ļ���������____��
(2)��֪��
������ | MgO | Al2O3 | MgCl2 | AlCl3 |
���� | ���ӻ����� | ���ӻ����� | ���ӻ����� | ���ۻ����� |
�۵�/�� | 2800 | 2050 | 714 | 191 |
��ҵ��þʱ�����MgCl2�������MgO��ԭ����_____������ʱ�����Al2O3�������AlCl3��ԭ����_____��
(3)����裨�۵�1410���������õİ뵼����ϡ��ɴֹ��ƴ���������£�
Si���֣�![]() SiCl4
SiCl4![]() SiCl4������
SiCl4������![]() Si������
Si������
д��SiCl4�ĵ���ʽ��_____��
(4)�������岻����Ũ����������P2O5�������_____��
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3������ʵ������O2�������Ӵ�����400��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1��д���÷�Ӧ�Ļ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɸ�������ɺ����ʽ��з��ࡣ����Cl2��Na��CO2��Na2O��Na2O2��NH3�������ʣ����������գ�
(1)�ɷ��ӹ��ɵĵ�����____________�����ڼ��Է��ӵ���____________��
(2)�������Ӽ����й��ۼ������ʵĵ���ʽΪ____________��
(3)���������������Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳����____________��
(4)������ˮ��Ӧ�IJ�ͬ���������ʿɷֳ�A�飨CO2��Na2O��NH3����B�飨Cl2��Na��Na2O2���������������________________________��
(5)�����Ը��������Һ�м���Na2O2����Һ��ɫ��������Ӧ![]() ��δ��ƽ������ƽ�÷�Ӧ�����ӷ���ʽ���������ת�Ʒ�������Ŀ��____________
��δ��ƽ������ƽ�÷�Ӧ�����ӷ���ʽ���������ת�Ʒ�������Ŀ��____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ���ǹ�ҵ��ͭ����Ҫԭ�ϣ�����Ҫ�ɷ�ΪCuFeS2������һ����Ȼ��ͭ��������ʯ����Ϊ�˲ⶨ�û�ͭ��Ĵ��ȣ�ijͬѧ���������ʵ�飺
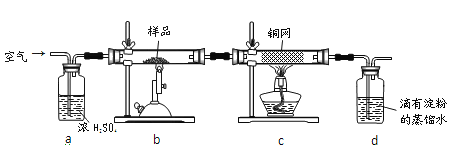
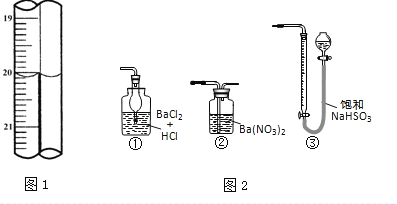
�ֳ�ȡ��ϸ�Ļ�ͭ����Ʒ1.150g���ڿ��������½������գ�����Cu��Fe3O4��SO2���壬ʵ���ȡd����Һ��1/10������ƿ�У���0.05mol/L������Һ���еζ���������Ϊ0.00mL��ĩ������ͼ1��ʾ�����������գ�
��1��������Ʒ���õ�����Ϊ___������Ʒ��ϸ���ٷ�Ӧ����Ŀ����__________��
��2��װ��a��������___________��������Ӧ����������ͨһ��ʱ��Ŀ�������Ŀ����___��
��3���ζ�ʱ��������Һ�������Ϊ___mL���жϵζ��Ѵ��յ��������_____________��
��4��ͨ�������֪���û�ͭ��Ĵ���Ϊ_________��
��5������ͼ2װ���������ʵ��װ��d��ͬ�����Դﵽʵ��Ŀ�ĵ���________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com