
【题目】用滴有酚酞和氯化钠溶液湿润的滤纸分别做甲、乙两个实验,下列判断错误的是( )

A.b极附近有气泡冒出B.d极附近出现红色
C.a、c极上都发生氧化反应D.甲中铁棒比乙中铁棒更易腐蚀
【答案】A
【解析】
甲构成原电池,乙为电解池,甲中铁发生吸氧腐蚀,正极上电极反应式为2H2O+O2+4e-=4OH-,乙中阴极上电极反应式为:2H++2e-=H2↑,水电离出的氢离子放电,导致阴极附近有大量OH-,溶液呈碱性,无色酚酞试液遇碱变红色,以此解答该题。
A、b极附是正极,发生电极反应式为2H2O+O2+4e-=4OH-,所以无气泡冒出,故A错误;
B、乙中阴极上电极反应式为:2H++2e-=H2↑,水电离出的氢离子放电,导致阴极附近有大量OH-,溶液呈碱性,无色酚酞试液遇碱变红色,故B正确;
C、a是原电池的负极发生氧化反应、c极是电解池的阳极发生氧化反应,所以a、c极上都发生氧化反应,故C正确;
D、甲中铁是原电池的负极被腐蚀,而乙中是电解池的阴极被保护,所以甲中铁棒比乙中铁棒更易腐蚀,故D正确;
故答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
【答案】 二 ⅥA 5 弱 硫原子半径大于氧原子半径,硫原子和氧原子的最外层电子数相等,硫原子的得电子能力比氧原子弱  在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
在溶液中,空气中的氧气将二氧化硫氧化为 H2SO4 SO2+ Ca(OH)2→CaSO3+ H2O(或2SO2+2Ca(OH)2+O2→ 2CaSO4 + 2H2O) 3∶1
【解析】试题分析:(1)氧原子核外有2个电子层,最外层有6个电子,硫原子核外电子排布式是1S22S22P63S23P4;(2)同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,锰元素化合价由+4降低为+2;(4)氧气能把二氧化硫氧化为 H2SO4;二氧化硫污染空气,用氢氧化钙能吸收二氧化硫;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,根据化合价升降相同计算物质的量之比。
解析:(1)氧原子核外有2个电子层,最外层有6个电子,所以氧元素在元素周期表中位于第二周期ⅥA族,硫原子核外电子排布式是1S22S22P63S23P4,有5个能级,所以有5种能量不同的电子;(2) 同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,所以S非金属性比O弱;(3)反应SO2 + MnO2 → MnSO4中,硫元素化合价由+4升高为+6,硫失去2个电子,锰元素化合价由+4降低为+2,锰元素得到2个电子,所以电子转移方向和数目是 ;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
;(4)氧气能把二氧化硫氧化为 H2SO4,所以反应后溶液中的 n(SO42-)明显大于 n(Mn2+);二氧化硫污染空气,氢氧化钙能吸收二氧化硫,反应方程式为SO2+ Ca(OH)2→CaSO3+ H2O;(5)NaHSO3与 Cr2O72-反应时,硫元素化合价由+4升高为+6,铬元素化合价由+6降低为+3,设NaHSO3与 Cr2O72-反应时的物质的量比为x∶y,根据化合价升降相同,2x=y×2×3,所以x∶y= 3∶1。
点睛:氧化还原反应中,氧化剂得电子化合价降低,还原剂失电子化合价升高,根据氧化还原反应的升降规律,氧化剂得电子数一定等于还原剂失电子数。
【题型】综合题
【结束】
22
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。

(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是______。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.单质的熔点降低
d.氧化物对应的水化物碱性减弱,酸性增强
原子最外层电子数与次外层电子数相同的元素名称为_____,氧化性最弱的简单阳离子是____。
(2)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是_____;制铝时,电解Al2O3而不电解AlCl3的原因是_____。
(3)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)![]() SiCl4
SiCl4![]() SiCl4(纯)
SiCl4(纯)![]() Si(纯)
Si(纯)
写出SiCl4的电子式:_____;
(4)下列气体不能用浓硫酸干燥,可用P2O5干燥的是_____。
a.NH3 b.HI c.SO2 d.CO2
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的____极,发生的电极反应式为______; X电极上发生的电极反应为______;(填反应类型)
(3)外电路中的电子是从_______电极流向________电极。Ag+向_______ (填正极或负极)移动。
(4)当有1.6g铜溶解时,银棒增重_________________。
(5)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:H2+O2--2e-=H2O; B极:O2+4e-=2O2-。则A极是电池的______极;电子从该极____(填“流入”或“流出”),该电池的总反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物可根据其组成和性质进行分类。现有Cl2、Na、CO2、Na2O、Na2O2、NH3六种物质,完成下列填空:
(1)由分子构成的单质是____________,属于极性分子的是____________。
(2)既有离子键又有共价键的物质的电子式为____________。
(3)上述化合物中组成元素的原子半径由大到小的顺序是____________。
(4)根据与水反应的不同,上述物质可分成A组(CO2、Na2O和NH3)和B组(Cl2、Na和Na2O2),分组的依据是________________________。
(5)在酸性高锰酸钾溶液中加入Na2O2,溶液褪色,发生反应![]() (未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
(未配平),配平该反应的离子方程式并标出电子转移方向与数目。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一个碳原子上连有两个羟基时,易发生下列转化:![]() 。请根据如图回答:
。请根据如图回答:
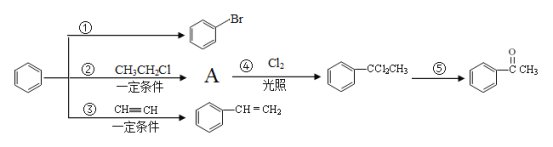
(1)物质A的化学式为C8H10,写出A的名称___,鉴别A和![]() 可选用的试剂是___。
可选用的试剂是___。
(2)写出反应①的化学反应方程式____。
(3)反应①~⑤中,属于加成反应的是____;反应⑤的反应条件为___。
(4)写出2种满足下列条件的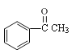 同分异构体的结构简式。___,____。
同分异构体的结构简式。___,____。
①含苯环结构 ②能发生银镜反应
(5)设计由![]() 制备
制备 ![]() 的合成路线(无机试剂任选)。_____
的合成路线(无机试剂任选)。_____
合成路线常用的表示方式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三种有机物 ![]() (x)
(x) ![]() (y)
(y)![]() (z),下列说法不正确的是
(z),下列说法不正确的是
A.x、y、z 互为同分异构体,z 的二氯代物有三种
B.x、y 的一氯代物均只有三种,z 的一氯代物有一种
C.x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D.x、y、z 中只有 x 的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com