
Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
(1)写出基态原子或离子的电子排布式:
Fe3+_________________;Cu _______________。
(2)比较 Fe2+与Fe3+的化学稳定性:Fe2+ Fe3+;半径大小:Fe2+ Fe3+(均填“>”或“<”)。
Ⅱ.(1)在第三周期中,第一电离能最小的元素是______,电负性最大的元素是_______(用元素符号表示)。
(2)第三周期原子中p轨道半充满的元素是_______ (用元素符号表示)。
(3)第二周期原子中,未成对电子数等于其周期序数的原子有 (用元素符号表示)。
Ⅲ.酞菁与酞菁铜染料分子结构如下图:酞菁分子中氮原子采用的杂化方式有: ,并在下图相应位置上标出酞菁铜结构中铜原子周围的配位键:
(10分)Ⅰ.(1)1s22s22p63s23p63d5(1分) 1s22s22p63s23p63d104s1(1分)
(2)< (1分) ,>(1分)
Ⅱ.(1)Na (1分),Cl(1分)(2)P(1分)(3)C和O(1分,少一个不给分)
Ⅲ.sp2和sp3(1分,少一个不给分)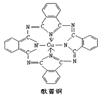 (1分)
(1分)
【解析】
试题分析:Ⅰ.(1)共计构造原理可知,铁离子和铜原子的电子排布式分别是1s22s22p63s23p63d5、1s22s22p63s23p63d104s1。
(2)铁离子的3d轨道电子处于半充满状态,所以稳定性强于亚铁离子的。但亚铁离子的半径大于铁离子的。
Ⅱ.(1)金属性越强,第一电离能越小,则在第三周期中,第一电离能最小的元素是Na。非金属性越强,电负性越大,所以在第三周期元素中电负性最大的元素是。
(2)根据核外电子排布可知,在第三周期原子中p轨道半充满的元素是P。
(3)据核外电子排布可知,第二周期原子中,未成对电子数等于其周期序数的原子有C和O。
Ⅲ.酞菁分子中部分氮原子含有2个σ键、一个孤对电子,所以采取sp2杂化,部分氮原子含有3个σ键、一个孤对电子,所以采取sp3杂化。由于氮原子含有孤对电子,而铜原子含有空轨道,所以二者可以形成配位健。
考点:考查核外电子排布、离子稳定性、离子半径以及杂化轨道和配位健的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查。主要是考查学生灵活运用基础知识解决实际问题的能力,有助于提高学生的应试能力和学习效率。


科目:高中化学 来源:2012-2013学年福建省南安一中高一下学期期中考试化学试卷(带解析) 题型:填空题
请按下列要求写出有关反应的离子方程式:
⑴铜与氯化铁的反应
⑵往氯化亚铁中通入氯气
⑶①向10L0.1 mol·L-1的NaHCO3溶液中滴入含有 0.5 mol Ba(OH)2的溶液.写出反应的离
子方程式 .
②向所得溶液中加入等体积同浓度的Ba(OH)2溶液.写出此步反应的离子方程式
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷(带解析) 题型:填空题
Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
⑴写出基态原子或离子的电子排布式:
①Fe3+_________________; ②Cr _______________; ③Cu _______________.
⑵比较 Fe2+与Fe3+的化学稳定性:Fe2+ Fe3+,半径大小:Fe2+ Fe3+
Ⅱ⑴在第三周期中,第一电离能最小的元素是________,电负性最大的元素是________(用元素符号表示)。
⑵第二、三、周期原子中p轨道半充满的元素是_______ (用元素符号表示)。
⑶第二周期原子中,未成对电子数等于周期系数的原子有 (用元素符号表示)
Ⅲ. (2010·滁州模拟)ClO、ClO、ClO中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构。
| 微粒 | ClO | ClO | ClO |
| 立体结构 | | | |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省牡丹江一中高二下学期期末考试化学试卷(带解析) 题型:填空题
Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
(1)写出基态原子或离子的电子排布式:
Fe3+_________________;Cu _______________。
(2)比较 Fe2+与Fe3+的化学稳定性:Fe2+ Fe3+;半径大小:Fe2+ Fe3+(均填“>”或“<”)。
Ⅱ.(1)在第三周期中,第一电离能最小的元素是______,电负性最大的元素是_______(用元素符号表示)。
(2)第三周期原子中p轨道半充满的元素是_______ (用元素符号表示)。
(3)第二周期原子中,未成对电子数等于其周期序数的原子有 (用元素符号表示)。
Ⅲ.酞菁与酞菁铜染料分子结构如下图:酞菁分子中氮原子采用的杂化方式有: ,并在下图相应位置上标出酞菁铜结构中铜原子周围的配位键:
查看答案和解析>>
科目:高中化学 来源:2015届福建省高一下学期期中考试化学试卷(解析版) 题型:填空题
请按下列要求写出有关反应的离子方程式:
⑴铜与氯化铁的反应
⑵往氯化亚铁中通入氯气
⑶①向10L0.1 mol·L-1的NaHCO3溶液中滴入含有 0.5 mol Ba(OH)2的溶液.写出反应的离
子方程式 .
②向所得溶液中加入等体积同浓度的Ba(OH)2溶液.写出此步反应的离子方程式
查看答案和解析>>
科目:高中化学 来源:2014届福建三明泰宁一中高二下第一次阶段考试化学试卷(解析版) 题型:填空题
Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
⑴写出基态原子或离子的电子排布式:
①Fe3+_________________; ②Cr _______________; ③Cu _______________.
⑵比较 Fe2+与Fe3+的化学稳定性:Fe2+ Fe3+,半径大小:Fe2+ Fe3+
Ⅱ⑴在第三周期中,第一电离能最小的元素是________,电负性最大的元素是________(用元素符号表示)。
⑵第二、三、周期原子中p轨道半充满的元素是_______ (用元素符号表示)。
⑶第二周期原子中,未成对电子数等于周期系数的原子有 (用元素符号表示)
Ⅲ. (2010·滁州模拟)ClO、ClO、ClO中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构。
|
微粒 |
ClO |
ClO |
ClO |
|
立体结构 |
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com