
【题目】化学反应的发生必然伴随着能量的转化,其最根本的原因是( )
A.化学反应中一定有新物质生成
B.能量变化是化学反应的基本特征之一
C.化学反应通常需要加热等条件才能发生
D.化学反应中旧的化学键断裂需要吸收能量,新的化学键的形成需要放出能量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在25mL的碱式滴定管中盛有溶液,液面恰好在20mL刻度处,现将滴定管内溶液全部放出,流入量筒内,所得溶液的体积为( )
A. 5mL B. 20mL C. 大于5mL D. 小于5mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子的叙述,正确的是( )
A.阴离子中不可能含金属元素
B.金属离子参与氧化还原反应时,既可能被氧化又可能被还原
C.Na2O2中阴阳离子个数比是1:1
D.NaCl固体不能导电,是因为固体中不存在阴阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质互为同系物的是( )
A. 金刚石和石墨 B. CH3-CH2-CH2-CH3和CH3-CH(CH3)-CH3
C. CH4 和 C2H6 D. 16O和18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为反应(选填“吸热”、“放热”).
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.平衡移动(选填“向正反应方向”、“向逆反应方向”、“不”).
(4)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K1.0(选填“大于”、“小于”、“等于”)
(5)若1200℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2molL﹣1、2molL﹣1、4molL﹣1、4molL﹣1 , 则此时上述反应的平衡移动方向为 . (选填“正反应方向”、“逆反应方向”、“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线a和b是盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是( ) 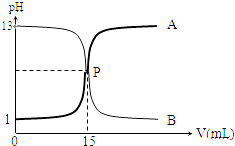
A.盐酸的物质的量浓度为1molL
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的说法中错误的是( )
A. 甲烷分子是由极性键构成的分子 B. 甲烷分子具有正四面体结构
C. 甲烷分子中四个C—H 是完全等价的键 D. 甲烷分子中具有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨的反应为N2+3H2![]() 2NH3+Q。下表是某次反应时NH3的浓度变化:
2NH3+Q。下表是某次反应时NH3的浓度变化:
时间(min) | 0 | 5 | 10 | 15 | 20 |
c(NH3)(mol/L) | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
完成下列填空:
(1)由表中数据计算0~10 min时,用H2表示的平均反应速率为________________。降低温度,反应的平衡常数将______________(填“增大”、“减小”或“不变”)。若要增大反应速率且提高H2利用率,可采取的措施有________________。
(2)若反应中气体混合物的密度保持不变,能否说明该反应已经达到平衡状态?并说明理由。____________________________________________________________________
(3)用右图所示装置进行有关氨气性质的实验,挤出胶头滴管中的水,打开止水夹后的实验现象是_____________。

(4)氨气溶于水后溶液显碱性的原因是(用方程式表示)____________________________________________。若在氨水中逐滴滴加盐酸,则溶液的pH将__________(填“增大”、“减小”或“不变”);当恰好完全反应时,则c(NH4+)________c(Cl-)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
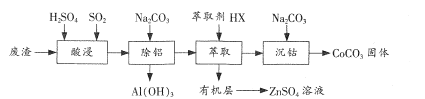
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

(1)“酸浸”时通入SO2的目的是__。
(2)“除铝”时调节溶液pH范围为__,该过程中主要反应的离子方程式为__。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是__。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是__。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 __。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为_______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com