
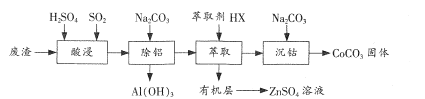
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

(1)“酸浸”时通入SO2的目的是__。
(2)“除铝”时调节溶液pH范围为__,该过程中主要反应的离子方程式为__。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是__。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是__。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 __。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为_______ 。
【答案】 将Co3+还原为Co2+ 5.0~5.4 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 向有机层中加入适量的硫酸溶液充分振荡,静置,分液 防止加入过快而产生Co(OH)2沉淀 2CoCO3![]() Co2O3+CO↑+CO2↑
Co2O3+CO↑+CO2↑
【解析】(1)“酸浸”时通入SO2的目的是将Co3+还原为Co2+;(2)“除铝”时调节溶液pH范围使铝完全沉淀但锌没有开始沉淀,则范围为5.0~5.4,该过程中主要反应的离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是向有机层中加入适量的硫酸溶液充分振荡,静置,分液;(4)“沉钴”时Na2CO3溶液需缓慢滴加,防止加入过快而产生Co(OH)2沉淀;(5)CoCO3隔绝空气灼烧可以生成Co2O3,同时生成二氧化碳,反应的化学方程式为2CoCO3
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是向有机层中加入适量的硫酸溶液充分振荡,静置,分液;(4)“沉钴”时Na2CO3溶液需缓慢滴加,防止加入过快而产生Co(OH)2沉淀;(5)CoCO3隔绝空气灼烧可以生成Co2O3,同时生成二氧化碳,反应的化学方程式为2CoCO3![]() Co2O3+CO↑+CO2↑。
Co2O3+CO↑+CO2↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学反应的发生必然伴随着能量的转化,其最根本的原因是( )
A.化学反应中一定有新物质生成
B.能量变化是化学反应的基本特征之一
C.化学反应通常需要加热等条件才能发生
D.化学反应中旧的化学键断裂需要吸收能量,新的化学键的形成需要放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.含有共价键的化合物一定是共价化合物
B.在共价化合物中一定含有共价键
C.含有离子键的化合物一定是离子化合物
D.单质分子中不一定有化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B. 等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C. 0.1 mol·L-1NH4Cl溶液加水稀释,![]() 的值减小
的值减小
D. 对于反应2SO2+O2![]() 2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
2SO3,使用催化剂能加快反应速率和提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是一种重要的化工产品,硫酸的用量被视为一个国家工业发达水平的一种标志。反应2SO2+O2![]() 2SO3是工业制取硫酸的主要反应之一,下列说法不正确的是( )
2SO3是工业制取硫酸的主要反应之一,下列说法不正确的是( )
A. 该反应为可逆反应,在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B. 达到平衡后,反应就停止了,正、逆反应速率相等且都为零
C. 在利用上述反应生产三氧化硫时,要考虑适当增大化学反应速率
D. 在利用上述反应生产三氧化硫时,要考虑使尽可能多的二氧化硫转化为三氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) 在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式 K= , △H0(填“>”、“<”或“=”).
(2)在一个容积为10L的密闭容器中,1300℃时加入 Fe、Fe2O3、CO、CO2各1mol,反应经过10min 后达到平衡.求该时间范围内反应的平均反应速率 v(CO2)= , CO 的平衡转化率为 .
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.增加Fe2O3的量
B.加入合适的催化剂
C.移出部分CO2
D.提高反应温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮的氧化物等,带来严重的环境污染。煤干馏是提高煤利用率、生产重要化工原料、降低污染物排放量的有效措施之一。
某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如下,请回答有关问题:
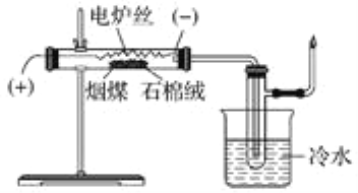
(1)煤干馏的条件是________________________________________________________
(2)盛有冷水的烧杯的作用是________________________________________________。
(3)实验后检验生成粗氨水的操作是_________________________________________。
(4)已知一氧化碳不能使溴水褪色,若将具支试管出来的气体通入溴水中,发现溴水褪色,则说明产生了_____________________________________________________________。
(5)检验具支试管出来的气体的性质后,将尾气点燃,火焰的颜色为______________。
(6)从煤焦油中分离出苯及其同系物的实验方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案的设计与评价合理的是 (_____)
A | B | C | D |
|
|
|
Ⅰ为Al电极,其他均为Cu电极 |
| 验证氧化性:Cl2>Br2>I2 | 验证温度对平衡移动的影响 | 电子流动方向:电极Ⅳ→A→电极Ⅰ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碘从碘水里分离出来,有下列基本操作:①静置后分液;②把碘水倒入分 液漏斗;③加入萃取剂四氯化碳,再充分振荡。正确的操作顺序是( )
A.①②③B.③②①
C.②③①D.③①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com