
����Ŀ������BaCl2��KCl�Ļ����ҺV L�������ֳ����ȷݡ�һ�ݵμ�ϡ���ᣬʹBa2+��ȫ����������a mol H2SO4����һ�ݵμ�AgNO3��Һ������b mol AgNO3ʹCl����ȫ������ԭ�����Һ�е�K+�����ʵ���Ũ��Ϊ______mol/L��
������������S ��SO32�� �� Fe2+ ��Al3+ ��Na ��HCl ��Na2O2�ڻ�ѧ��Ӧ��ֻ�ܱ���������______![]() �����
�����![]() ��ֻ�ܱ��ֳ������Ե���______
��ֻ�ܱ��ֳ������Ե���______![]() �����
�����![]() ��
��
��һ��������, PbO2��Cr3+��Ӧ��������Cr2O72����Pb2+������1 mol Cr3+��Ӧ����PbO2�����ʵ���Ϊ______mol��
����һ�������£�ʵ���ҷֱ��Թ������⡢������ء�����ء���������Ϊԭ����ȡ����,���Ƶ�ͬ��ͬѹ����ͬ���������ʱ���ĸ���Ӧ��ת�Ƶĵ�����֮��Ϊ______��
������ˮ�е�NO3�������ཡ������Σ����Ϊ�˽�������ˮ��NO3����Ũ�ȣ�ij�о���Ա����ڼ�����������Al�ۻ�ԭNO3����������N2�����ķ�Ӧ�ɱ�ʾ���£�����ɷ���ʽ����ƽ��____Al + ____NO3��+ ________ == ____AlO2�� + ____N2�� +____ H2O��
��ij��ѧ��Ӧ�ķ�Ӧ��Ͳ��![]()
�ٸ÷�Ӧ������������______��
�����÷�Ӧ����ʽ��I2��KIO3�ļ������ֱ���6��3�������±ߵĻ�ѧʽ���õ����ű������ת�Ƶķ������Ŀ��KMnO4 + KI + H2SO4��______��
���𰸡�![]() �� �� 1.5 1��2��2��1 10 6 4OH�� 10 3 2 I2��KIO3
�� �� 1.5 1��2��2��1 10 6 4OH�� 10 3 2 I2��KIO3 ![]()
��������
��BaCl2��NaCl�Ļ����ҺV L���������ֳ����ݣ�һ�ݵμ�ϡ���ᣬʹBa2+��ȫ����������a mol ���ᣬ��SO42�� + Ba2+ == BaSO4��
n(BaCl2) = a mol
��һ�ݵμ�AgNO3��Һ��ʹCl����ȫ��������Ӧ������b mol AgNO3,��
Ag+ + Cl�� == AgCl��
n(Cl��) = b mol
n(KCl) = b mol �C a mol��2 = (b �C 2a) mol

�ʴ�Ϊ��![]() ��
��
�Ƣ�������0�ۣ������м��̬���������������л�ԭ�ԣ�
����������������м��̬���������������л�ԭ�ԣ�
���������Ӵ����м��̬���������������л�ԭ�ԣ�
�������Ӵ�����ۣ�ֻ���������ԣ�
���Ƶ��ʴ�����ͼۣ�ֻ���л�ԭ�ԣ�
��HCl�������ۣ��ȴ�����ͼۣ���˾������������л�ԭ�ԣ�
�߹������ƴ����м��̬����˾������������л�ԭ�ԣ�
�ڻ�ѧ��Ӧ��ֻ�ܱ��������Ǣݣ�ֻ�ܱ��ֳ������Ե��Ǣܣ�
�ʴ�Ϊ�ݣ��ܣ�
����һ�������£�PbO2����Һ��Cr3+��Ӧ��������Cr2O72����Pb2+����Ӧ��Cr�ļ�̬������3�ۣ�pb�Ļ��ϼ۽���2�ۣ����ݵ����غ㣬������1 mol Cr3+��Ӧ����PbO2�����ʵ���Ϊ1.5 mol��
�ʴ�Ϊ��1.5��
���ø�����ء����������������Ӧ������O��-2��ת��Ϊ0�ۣ�������1 mol��������ת��4mol���ӣ����ù����������������������O����-1��ת��Ϊ0�ۣ�������1 mol��������ת��2 mol���ӣ����Ƶ�ͬ��ͬѹ����ͬ���������ʱ���ĸ���Ӧ��ת�Ƶĵ�����֮��Ϊ1��2��2��1��
�ʴ�Ϊ��1��2��2��1��
�ɷ�Ӧ��Al��AlO2����AlԪ�ػ��ϼ���0������Ϊ+3�ۣ�������3�ۣ�NO3����N2����Ԫ�ػ��ϼ���+5�۽���Ϊ0�ۣ�������10�ۣ����ϼ�������С������Ϊ30����Al��ϵ��Ϊ10��N2ϵ��Ϊ3���ɵ�Ԫ���غ��֪ϵ��Ϊ6����AlԪ���غ��֪ϵ��Ϊ10���ɵ���غ��֪ϵ��Ϊ����HԪ���غ��֪ϵ��Ϊ������ƽ�����ӷ���ʽΪ��
10Al + 6 NO3��+ 4OH�� == AlO2�� + 3 N2�� + 2 H2O��
�ʴ�Ϊ��10��6��4OH����10��3��2��
�ʢٷ�Ӧ��MnԪ�ػ��ϼ۽��ͣ�����ԭ��IԪ�ػ��ϼ���-1�۷ֱ�仯Ϊ0�ۡ�+5�ۣ���I2��KIO3Ϊ�������
�ʴ�Ϊ��I2��KIO3��
�����÷�Ӧ����ʽ��I2��KIO3�ļ������ֱ���6��3����IԪ��ʧȥ���ӵ���ĿΪ
2��6(1-0)+3��[5-(-1)]=30������ת�Ʒ������Ŀ�ɱ�ʾΪ![]() ,
,
�ʴ�Ϊ��![]() ��
��


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������ǿ������Һ����Ҫ��HO2-���ڡ��ҹ��о���Al-H2O2ȼ�ϵ�ؿ��������Դ�Ŀ��顢�������ȹ����Ƽ�����װ��ʾ��ͼ���¡�����˵���������
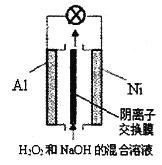
A. ��ع���ʱ����Һ��OH-ͨ�������ӽ���Ĥ��Al��Ǩ��
B. Ni���ĵ缫��Ӧʽ��HO2-+2e-+H2O=3OH-
C. ��ع��������������Һ��pH����
D. Al�缫��������13.5g����·��ͨ��9.03��1023������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��ж�����Ⱦ������е������NOx����CO��SO2�ȣ������ཡ������������Ӱ�죬��ѧ�ڽ��������Ⱦ�з�������Ҫ���á�
��1��úȼ�ղ����������к��е����������CH4����ԭ������Ⱦ����д��CH4��NO2��Ӧ�Ļ�ѧ����ʽ_____________��
��2������β����CO��NO2������һ�������¿��Է�����Ӧ��
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ��H=-746.8kJ��mol-1
N2(g)+2CO2(g) ��H=-746.8kJ��mol-1
4CO(g)+2NO2(g)![]() 3CO2(g)+N2(g) ��H=-1200kJ��mol-1
3CO2(g)+N2(g) ��H=-1200kJ��mol-1
��Ӧ��CO(g)+NO2(g)![]() CO2(g)+NO(g) ��H=_____kJ��mol-1
CO2(g)+NO(g) ��H=_____kJ��mol-1
��3���������������������ת��SO2(g)+NO2(g)![]() SO3(g)+NO(g)��ʵ����ƽ�ⳣ�� ���¶ȵĹ�ϵ����ͼ��ʾ���ش��������⣺
SO3(g)+NO(g)��ʵ����ƽ�ⳣ�� ���¶ȵĹ�ϵ����ͼ��ʾ���ش��������⣺

�ٸ÷�Ӧ����Ӧ�Ļ��___���������������������淴Ӧ�Ļ�ܡ�
�ڷ�Ӧ����v=V��-V��=k��xSO2��xNO2-k��xSO3��xNO��k����k���ֱ�Ϊ��������Ӧ���ʳ�����xΪ���ʵ���������T��ʱ��k��_____k������������������������=������
��T��ʱ�������Ϊ2L�������м���1molSO2(g)��1molNO2(g)��5minʱ���xSO3=0.2����ʱƽ����___����������������������Ӧ�����ƶ���![]() =___������2λС������
=___������2λС������
��4����֪��2NO(g)=N2(g)+O2(g) ��H=��180.6kJ/mol����ij��������������£�NO���Էֽ�����N2��O2���䷴Ӧ�����ɼ�Ϊ��
��һ����2NO ��N2O2 ��
�ڶ�����N2O2 ��N2+O2 ��
���б�����ȷ����____������)��
A�����л��Ϸ�Ӧ���Ƿ��ȷ�Ӧ
B��N2O2�Ǹ÷�Ӧ�ĵ��м����
C��������ʵĴ������Լ�С��Ӧ����H���ӿ췴Ӧ����
D����һ���Ļ�ܱȵڶ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������ʴ�����з�������ȷ����
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | 8Сʱδ�۲� ��������ʴ | 8Сʱδ�۲� ��������ʴ | 1Сʱ�۲� ��������ʴ |
A. ���У�NaCl��Һ���ܽ��O2������ʹ����Ƭ������ʴ
B. ���У�����Ƭδ������ʴ��ԭ��֮һ��ȱ��H2O
C. ����������Ӧ��O2+4e+ 2H2O ==4OH
D. �ԱȢ٢ڢۣ�˵�����ܸ���O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��S16O2��18O2�ڸ��������·�����Ӧ2SO2+O2![]() 2SO3���ﵽ��ѧƽ�����ƽ�������к�18O����( )
2SO3���ﵽ��ѧƽ�����ƽ�������к�18O����( )
A. ֻ��SO3 B. ֻ��SO2��SO3 C. ��SO2��SO3��O2 D. ֻ��O2��SO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ2SO2+O2![]() 2SO3�������ж���ȷ��( )
2SO3�������ж���ȷ��( )
A. ��״������2L SO2������O2��Ӧ��������2L SO3
B. ƽ��ʱ������������ͨ��O2����ʹSO2��ת���ʴﵽ100%
C. ƽ��ʱ��SO2���������ʱض�����O2�������ʵĶ���
D. ƽ��ʱ��SO2��Ũ�ȱض�����O2Ũ�ȵĶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ʾ�ף��������������Ӵ��ڲ�ͬŨ��ʱ����������Ĺ�ϵ;ͼ2��ʾ��ͬŨ�ȸƶ�ijֲ�ﻨ���ȷ��ͻ��۹�������Ӱ�졣����������ȷ����

A.ͬ������Լס����������ӵ���������ͬ
B.������ʵ�ʿ��ǣ�c��dŨ����ȣ�Ҫ����߲�����dŨ��Ϊ���
C.����Ũ�ȵĸ������ڻ��۹ܵ�����
D.��һ����Χ�ڣ��Ƶ�Ũ�ȶԻ����ȷ�����Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ�����ȷ���ǣ� ��
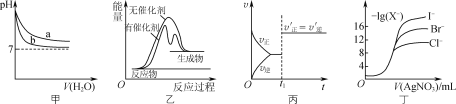
A. ͼ�ױ�ʾpH��ͬ��NaOH��Һ�백ˮϡ����pH�ı仯������a��Ӧ��ˮ
B. ͼ�ұ�ʾij���ȷ�Ӧ�ֱ����С�����������£���Ӧ�����е������仯
C. ͼ����ʾCO(g)��Cl2(g)![]() COCl2(g)�ķ�Ӧ������ʱ��ı仯����t1ʱ�ı�������Ǽ������
COCl2(g)�ķ�Ӧ������ʱ��ı仯����t1ʱ�ı�������Ǽ������
D. ͼ����ʾ��0.0100mol��L��1������������Һ�ζ�Ũ�Ⱦ�Ϊ0.1000mol��L��1 Cl����Br����I���Ļ����Һʱ���ȳ�������Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС����̽����Ӧ2Fe2+ + I2![]() 2Fe3+ + 2I���������ʵ�飺
2Fe3+ + 2I���������ʵ�飺
���ϣ�AgI�ǻ�ɫ���壬������ϡ���ᡣ���Ƶ�AgI����������ֽ⡣

(1)���δ���Fe3+�������������Fe3+��ʵ������������ǣ�ȡ����������Һ��______��
(2)���еĻ�ɫ������______��
(3)�����飬������Ĺ����в�����Fe3+��
�ٶ�Fe3+������ԭ���������¼��裺
����a�������д���O2������______(�����ӷ���ʽ��ʾ)���ɲ���Fe3+��
����b����Һ��Ag+���������ԣ��ɲ���Fe3+��
����c�� ______��
����d���������£�I2��Һ�ɽ�Fe2+����ΪFe3+��
��ͨ��ʵ���һ��֤ʵa��b��c���Dz���Fe3+����Ҫԭ����d������������Ĺ�����I2��Һ����Fe2+��ԭ����______��
(4)�����飬���лҺ�ɫ�����к���AgI��Ag��
����֤�Һ�ɫ���Ǻ���Ag��ʵ������������ǣ�ȡϴ����ĻҺ�ɫ���壬______��
�� Ϊ̽�����������ֻҺ�ɫ���ǵ�ԭ�������ʵ��1��ʵ��2��
ʵ��1����1 mL 0.1 mol��L1 FeSO4��Һ�м���1 mL0.1 mol��L1 AgNO3��Һ����ʼʱ����Һ�����Ա仯�������Ӻ��ִ����Һ�ɫ���ǡ���Ӧ�������¶ȼ����ޱ仯���ⶨ��Һ��Ag+Ũ���淴Ӧʱ��ı仯����ͼ��

ʵ��2��ʵ�鿪ʼʱ�������Թ��м��뼸��Fe2(SO4)3��Һ���ظ�ʵ��1��ʵ������ʵ��1��ͬ��
����ʵ��1�з�����Ӧ�����ӷ���ʽ��______��
��������Ѹ�����ֻҺ�ɫ���ǵĿ��ܵ�ԭ����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com