C
解析试题分析:要对各组所给的各种物质进行合理分析,将其中一种与其他的反应只要每次现象不同就可以区分,则
A中硫酸铜在溶液中显蓝色,首先鉴别出来。硫酸铜和氢氧化钾反应生成蓝色沉淀氢氧化铜,进而鉴别出来氢氧化钾。氢氧化钾和硝酸镁反应生成白色沉淀氢氧化镁进而鉴别出来硝酸镁,剩余的是盐酸,可以鉴别。
B、
| NaBr
| AgNO3
| HCl
| Na2CO3
|
NaBr
| 无现象
| 浅黄色沉淀
| 无现象
| 无现象
|
AgNO3
| 浅黄色沉淀
| 无现象
| 白色沉淀
| 白色沉淀
|
HCl
| 无现象
| 白色沉淀
| 无现象
| 有气体产生
|
Na2CO3
| 无现象
| 白色沉淀
| 有气体产生
| 无现象
|
由于碳酸钠和盐酸反应是分布进行的,则二者的滴加顺序不同,实验现象不同,可以鉴别。
C、
| H2SO4
| NaCl
| Na2SO4
| Na2CO3
|
H2SO4
| 无现象
| 无现象
| 沉淀、气体
| 产生气体
|
NaCl
|
练习册系列答案
相关习题
科目:高中化学
来源:
题型:单选题
下列能够检验出KI溶液中含有Br-的实验是 | A.加入足量的新氯水,溶液颜色变深,则含有Br- | | B.加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- | | C.加入少量的碘水,再加入CC14振荡,CC14层有色,则含有Br- | | D.加入足量FeC13溶液,用CC14萃取后,在水层中加入足量氯水,再用CC14萃取后有机层呈红棕色, |
则含有Br -
查看答案和解析>>
科目:高中化学
来源:
题型:单选题
下列除杂方法合理的是 | A.C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱石灰干燥 | | B.CaCO3中混有的少量NaHCO3,可以用加热的方法除去 | | C.乙烯中混有的SO2气体,可以通过酸性高锰酸钾溶液除去 | | D.H2S中混有的水蒸气,可以用浓硫酸除去 |
查看答案和解析>>
科目:高中化学
来源:
题型:单选题
下列常用的混合物分离或提纯操作中,需使用冷凝器的是
查看答案和解析>>
科目:高中化学
来源:
题型:单选题
已知甲、乙的某些性质如下:
物质
| 密度/(g·mL-1)
| 沸点
| 溶解性
| 甲
| 0.893
| 78.5℃
| 能溶于水且溶于乙
| 乙
| 1.220
| 100.7℃
| 能溶于水且溶于甲
|
将甲、乙两种有机物组成的混合物进行分离,则应采取的分离方法是( ) A.蒸馏 B.干馏 C.分液 D.过滤
查看答案和解析>>
科目:高中化学
来源:
题型:单选题
乙烯中混有SO2气体,欲除去SO2,得到较纯净的乙烯,最好依次通过下列哪组试剂的洗气瓶( ) | A.酸性KMnO4溶液、浓H2SO4 | B.溴水、浓H2SO4 | | C.浓H2SO4、酸性KMnO4溶液 | D.NaOH溶液、浓H2SO4 |
查看答案和解析>>
科目:高中化学
来源:
题型:填空题
海水的综合利用可以制备金属镁,其流程如下图所示:

提示:①MgCl2晶体的化学式为MgCl2·6H2O;
②MgO的熔点为2852oC,无水MgCl2的熔点为714oC。
(1)操作②的名称是________、________、过滤。
(2)试剂a的名称是_______________________。
(3)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤_____________________________
_________________________________________________________________________。
(4)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质;而不采用:加热Mg(OH)2得到MgO,再电解熔融MgO的方法制金属镁,其原因是_______________________________。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明下列情况下使用玻璃棒的目的;
过滤时:__________________________、蒸发时:________________________
查看答案和解析>>
科目:高中化学
来源:
题型:填空题
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为 ,操作Ⅱ的名称是 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。
查看答案和解析>>
科目:高中化学
来源:
题型:填空题
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。
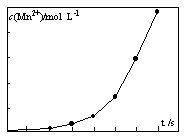
查看答案和解析>>
|



1加1阅读好卷系列答案
专项复习训练系列答案
初中语文教与学阅读系列答案

完形填空与阅读理解周秘计划系列答案
英语阅读理解150篇系列答案
奔腾英语系列答案
标准阅读系列答案
53English系列答案
考纲强化阅读系列答案



