
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。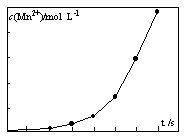
(1)NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解。(2分)
(2)(NH4)2SO4(2分)
(3)解:由题意知,C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
5 2
n 20.4×10-3×0.2000mol
解得 n=0.0102mol (4分)
(4)生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。(2分)
解析试题分析:(1)温度不宜过高的原因除了控制沉淀的粒径外,还有NH3?H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解
(2)沉淀步骤中加入一水合氨,生成氢氧化亚铁沉淀的同时还有硫酸铵生成,所以副产品是(NH4)2SO4
(3)由题意知氧化C2O42-和Fe2+共消耗0.2000 mol·L-1标准KMnO4溶液体积30.40 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42-消耗KMnO4溶液体积为(30.40-10.00)=20.4mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以C2O42-的物质的量为20.4×10-3×0.2000×5/2=0.0102mol;
(4)从图像上观察,随着反应对进行,曲线的斜率越来越大,说明单位时间内Mn2+的浓度越来越大,所以反应速率越来越快,反应中若温度不变,只能是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。
考点:考查物质制备,对操作、图像的分析,氧化还原反应对计算


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列各组溶液,不用其它试剂,无法将它们区别开的是
| A.HCl、CuSO4、Mg(NO3)2、KOH | B.NaBr、AgNO3、HCl、Na2CO3 |
| C.H2SO4、NaCl、Na2SO4、Na2CO3 | D.NaOH、MgSO4、Na2CO3、KHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从化工厂铬渣中提取硫酸钠的工艺如下: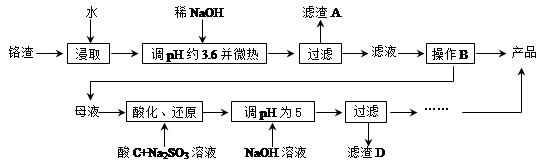
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5 mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填字母序号)
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为: ;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。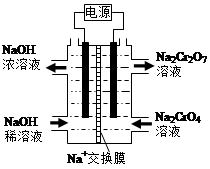
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定CaC2样品的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。
(1)A瓶中的液体可以从酸性KMnO4溶液和FeCl3溶液中选择,应该选择________,它的作用是___________________________。
(2)装置Ⅰ的主要缺点是______________________________________。
(3)装置Ⅱ的主要缺点是_____________________;
若选用此装置来完成实验,则应采取的措施是___________________。
(4)若称取a g CaC2,反应完全后,测得B处溴水增重b g,则CaC2的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
 )
)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成份为Fe(CrO2)2]为主要原料生产重铬酸钠晶体( Na2Cr2O7·2H2O)的主要工艺流程如下:
己知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3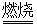 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为____。
(2)滤渣1的成分为________,滤渣2的成分为____。
(3)将滤渣l放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是 。
(4)铬铁矿中的Al2O3杂质在工业上可用来冶炼铝,该化学方程式为
(5)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mo1/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀 ,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
②还原法: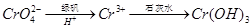 。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
(6)某高效净水剂是由K2FeO4得到的,工业上以溶液W、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、40. 2 g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
计算25℃时0.7mol·L-1硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com