
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、40. 2 g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
计算25℃时0.7mol·L-1硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |

(1)分批慢慢加入稀硫酸 (2分)
(2)Fe3+、Fe2+、Al3+(2分,全对才得分) 2 Fe2+ +2H+ +H2O2 = 2Fe3+ +2H2O(2分)
(3)防止因温度下降时H3BO3从溶液中析出(2分)
(4)加压升温结晶(2分)
(5) H3BO3 (aq)+H2O (l) [B(OH)4]- (aq)+H+(aq)
[B(OH)4]- (aq)+H+(aq)
起始时各物质浓度/ mol·L-1: 0.70 0 0
平衡时各物质浓度/ mol·L-1: 0.70-x x x
K= =
=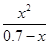 =
=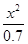 =5.7×10-10
=5.7×10-10
x2=3.99×10-10 x=2×10-5(mol·L-1)
(共4分。两段式1分;K的表达式1分;代入数字的式子1分;结果1分)
(6)BD(2分)
解析试题分析:(1)浸取矿粉时,矿分中含有石灰石,所以如果一次性加入硫酸,会导致CaCO3分解产生大量气泡,所以防止大量气泡产生,可以控制加入硫酸的量来控制反应,所以可以分批慢慢加入硫酸。
(2)含有的Fe2+、Fe3+、Al3+等杂质离子在pH分别为3. 2、 5.2、9.7时沉淀,而Mg2+在12.4沉淀,所以要用Mg0调节pH使杂质离子沉淀,应该先把Fe2+ 氧化为Fe3+ 而沉淀除去,而最终能够沉淀的离子只有Fe2+、Fe3+、Al3+ ,双氧水的作用为把Fe2+ 氧化为Fe3+ ,反应方程式为2 Fe2+ +2H+ +H2O2 = 2Fe3+ +2H2O。
(3)由于H3BO3在水中的溶解度随温度增大而增大,所以要浸取得到更多的产品,应加热浸出液,并采用热过滤的方法过滤,防止因温度降低H3BO3在水中析出。
(4)从图像可以看出,硫酸镁随着温度不同容易形成不同的晶体,而要收集
到的MgS04·H20在较高温度下才结晶,且该晶体的溶解度随温度升高而减小,所以
要在接近200℃的较高温度下得到该晶体,常压下蒸发结晶较难,应该选择加压升温结晶的方法。
(5) H3BO3 (aq)+H2O (l) [B(OH)4]- (aq)+H+(aq)
[B(OH)4]- (aq)+H+(aq)
起始时各物质浓度/ mol·L-1: 0.70 0 0
平衡时各物质浓度/ mol·L-1: 0.70-x x x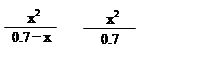 K=
K= = = =5.7×10-10
= = =5.7×10-10
x2=3.99×10-10 x=2×10-5(mol·L-1)
(6)对比硼酸和表格中碳酸、醋酸的电离程度,可知3者的酸性大小为:醋酸>碳酸>硼酸>HCO3-,所以根据酸性大小分析:根据强酸制弱酸原理,碳酸钠溶液滴入硼酸中不能有气泡产生,A错误;碳酸钠溶液滴入醋酸中能观察到有气泡产生 ,B正确;等浓度的碳酸和硼酸溶液比较,碳酸酸性强,pH值小,C错误;等浓度的碳酸钠和醋酸钠溶液比较,碳酸钠水解程度大,碱性强,所以pH大,D正确。故选BD。
,B正确;等浓度的碳酸和硼酸溶液比较,碳酸酸性强,pH值小,C错误;等浓度的碳酸钠和醋酸钠溶液比较,碳酸钠水解程度大,碱性强,所以pH大,D正确。故选BD。
考点:本题考查的是化学工艺流程题,涉及离子的沉淀、晶体的制备、电离平衡常数的计算和应用等知识。


科目:高中化学 来源: 题型:填空题
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。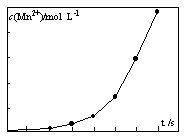
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着不断向化工、石油、电力、海水淡化、建筑、日常生活用品等行业推广,钛金属日益被人们重视,被誉为“现代金属”和“战略金属”,是提高国防装备水平不可或缺的重要战略物资。工业主要以二氧化钛为原料冶炼金属钛。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: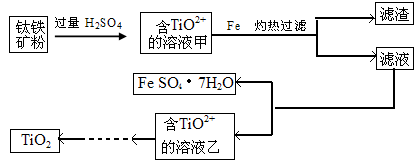
(1)由滤液获得绿矾晶体的操作过程是 。
(2)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(3)已知10kg该钛铁矿中铁元素的质量分数为33.6%,能够得到绿矾晶体22.24kg,试计算最少加入铁粉的质量。
方法2:TiCl4水解生成TiO2·XH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(4)①TiCl4水解生成TiO2·XH2O的化学方程式为 。
②检验TiO2·XH2O中Cl-是否被除净的方法是 。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下: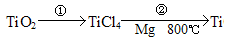
反应②的化学方程式是 ,该反应成功需要的其他条件及原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: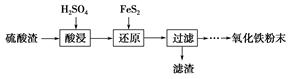
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率;②________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,该反应的离子方程式为________________________________________________________________________。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入稀盐酸、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应的化学方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62—
Sn2++4Cl-+2HgCl2=SnCl62—+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量________(填“偏高”、“偏低”或“不变”,下同);
②若不加HgCl2,则测定的Fe3+量________。
(4)①可选用________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是________________________________________________________________________(用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过硫酸钾( )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式_____________________________________
___________________________________。
(2)已知相关物质的溶解度曲线如右图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,________________,干燥。
(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.300 0 g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.00 0 g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00 mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是____________________________________________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______________。
③为确保实验结果的准确性,你认为还需要____________________________。
(4)将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用石灰乳、石灰氮(CaCN2)和炼厂气(含H2S)反应,既能净化尾气,又能获得应用广泛的CS(NH2)2(硫脲),其部分工艺流程如下: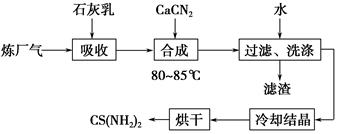
(1)高温下,H2S存在下列反应:2H2S(g)??2H2(g)+S2(g),其平衡常数表达式为K=________________。
(2)用石灰乳吸收H2S制取Ca(HS)2需要在低温下进行,其原因是_____________________________________________________;
过滤得到的滤渣可再利用,滤渣的主要成分是________(填化学式)。
(3)合成硫脲需长时间搅拌,并在较高温度(80~85 ℃)下进行,其目的是_______________________________________。
Ca(HS)2与CaCN2在水溶液中合成硫脲的化学方程式为________________________________。
(4)化合物X与硫脲互为同分异构体,X加入FeCl3溶液中,溶液显红色,X的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“天蓝蓝海蓝蓝,海边小城威海卫”。威海海水资源丰富,回答下列问题:
(1)海水中主要含有 等离子(写离子符号,至少答出4种)。
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法。其工艺流程如下图所示: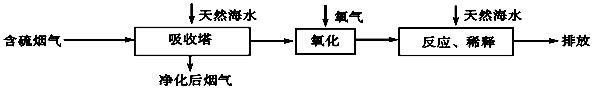
天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是: ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
(3)下图是海水综合利用的一个方面。
请回答下列问题:
I.①步主要反应的离子方程式: 。
溴及其化合物的用途有很多,写出其中的一种 。
II.第③步需要加入 ,其前面分离出氢氧化镁的操作称为 ,将镁条在二氧化碳中燃烧的产物为 。
III.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 正确的操作顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下: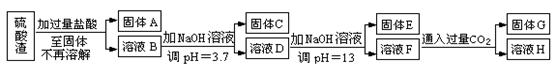
查资料得知:
| 物质名称 | 溶度积(Ksp) | pH值 | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8×10-16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿(主要成份:CuO ZnO)的方案,实现废物综合利用,方案如下图所示。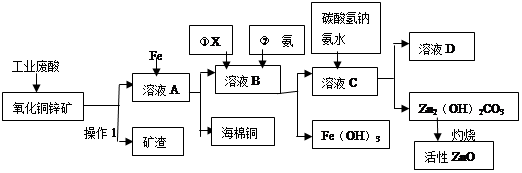
请回答下列问题:
(1)操作1的名称是:
(2)向溶液A中加入Fe粉发生的主要的反应离子方程式为: 、 。
(3)向溶液B中加入物质X的目的是 ,物质X可用下列物质中的 。(填字母)
| A.KMnO4 | B.O2 | C.H2O2 | D.NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com