
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
(1)烧杯、玻璃棒、漏斗(3分);
(2)将Fe2+完全氧化为Fe3+,便于完全沉淀(2分);5.2~5.4(2分);AD(2分)
(3)除去溶液中的Cu2+(1分);冷却结晶(1分)
(4)5(2分)
解析试题分析:(1)过滤操作中需要的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)溶液中的铁、铝元素最终以沉淀形式除去,所以加入适量H2O2溶液的目的是将Fe2+完全氧化为Fe3+,便于完全沉淀;根据表中数据pH=5.2时Al(OH)3完全沉淀,Fe(OH)3也已沉淀完全,但Zn(OH)2不能沉淀,所以溶液的pH范围为5.2~5.4;加入的试剂或药品既能中和酸调节pH值,同时不能引入新的杂质,所以只能选择AD;
(3)溶液中的铁、铝元素除去后仍存在铜离子,所以加入Zn粉目的是除去铜离子;加热浓缩后的步骤是冷却结晶;
(4)Ksp〔Cu(OH)2〕=2×10-20,溶液中c(Cu2+)=0.02 mol·L-1,所以只需c(Cu2+)×c(OH-)2>=2×10-20, Cu(OH)2沉淀即可生成,解得c(OH-)>=1×10-9,所以pH>=5.
考点:考查仪器的选择,溶液的除杂,对实验步骤的分析判断,溶液pH的计算


科目:高中化学 来源: 题型:单选题
已知甲、乙的某些性质如下:
| 物质 | 密度/(g·mL-1) | 沸点 | 溶解性 |
| 甲 | 0.893 | 78.5℃ | 能溶于水且溶于乙 |
| 乙 | 1.220 | 100.7℃ | 能溶于水且溶于甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、 、
、 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行实验:
,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+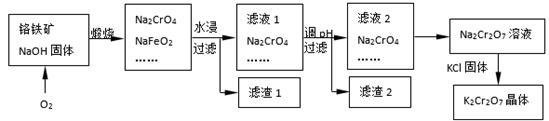
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某科研小组从含有较多Ag+、Fe3+、Al3+的工业废水中,按下图所示方法分离和提取金属单质:
已知:实验室甲、乙、丙、丁四种物质只能从氨水、碳酸铵、氢氧化钠、稀硫酸、葡萄糖五种溶液中选择,也可以用这五种溶液来制备。
对该实验分析正确的是
A.金属A、B、C分别为Ag、Fe、Al
B.g、f都为氧化物,工业上均采用电解g与f获得对应金属单质
C.沉淀b为混合物,主要成分为沉淀d和沉淀e
D.甲是氢氧化钠,丁为稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
已知:①5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。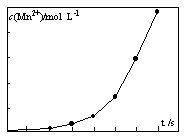
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下:
请回答下列问题:
(1)向粗液1中加入的水最后需要 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是 。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为 。
(4)写出阳极的电极反应式 。说明电解液循环的原因 。
(5)写出铝热法炼锰的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):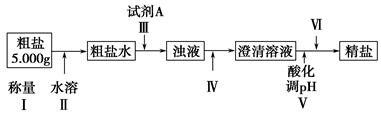
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
A.烧杯 B.试管 C.玻璃棒 D.分液漏斗 E.漏斗 F.酒精灯
G.蒸发皿
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→________→________。
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是___________________________________
(4)操作Ⅴ应选择的酸是________,若将操作Ⅴ与操作Ⅳ的先后顺序对调,将会对实验结果产生的影响是___________________________________
(5)操作Ⅵ是________(选择合理操作的名称,用标号字母按操作先后顺序填写)。
a.过滤、洗涤 B.蒸发、浓缩 c.萃取、分液 D.冷却、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过硫酸钾( )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液。写出电解时发生反应的离子方程式_____________________________________
___________________________________。
(2)已知相关物质的溶解度曲线如右图所示。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,________________,干燥。
(3)样品中过硫酸钾的含量可用碘量法进行测定。实验步骤如下:
步骤1:称取过硫酸钾样品0.300 0 g于碘量瓶中,加入30 mL水溶解。
步骤2:向溶液中加入4.00 0 g KI固体(略过量),摇匀,在暗处放置30 min。
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.100 0 mol·L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00 mL。
(已知反应:I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将碘量瓶“在暗处放置30 min”,立即进行步骤3,则测定的结果可能________(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是____________________________________________。
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______________。
③为确保实验结果的准确性,你认为还需要____________________________。
(4)将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图所示(H+浓度未画出)。图中物质X的化学式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com