
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、 、
、 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行实验:
,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:单选题
下列使用漏斗的几个实验装置中,设计正确且能达到实验目的的是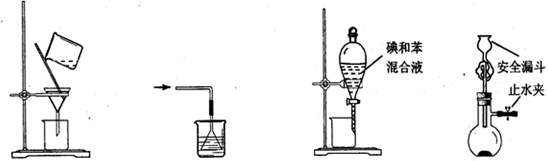
图1 图2 图3 图4
| A.用图1所示装置进行过滤,过滤时不断搅拌 |
| B.用图2所示装置吸收NH3制氨水 |
| C.用图3所示装置用苯萃取碘水中的碘,并把碘的苯溶液从漏斗下口放出 |
| D.用图4所示装置用石灰石与稀盐酸制取CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)已知将MnO2、ZnS浸在硫酸溶液中有少量黄色物质析出,写出并配平该化学反应方程式: 。
(2)在酸浸的过程中还会发生以下反应:
a. 3MnO2 +2FeS +6H2SO4=3MnSO4 +Fe2(SO4)3+2S+ 6H2O
b. MnO2+CuS+4H2SO4=MnSO4+CuSO4+S+2H2O
c. Al2O3+3H2SO4=Al2(SO4)3+3H2O
将酸浸所得的酸性溶液按以下的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn。
①操作①中加Zn粉后发生反应的离子方程式为:Zn+2H+=Zn2++H2↑、
Zn+Cu2+=Zn2++Cu、 。
②操作②中加入适量X的作用是: 。
③操作③中所加碳酸盐的化学式是: 。
(3)为了从上述流程中产生的Fe(OH)3 、Al(OH)3沉淀混合物中回收Al(OH)3,某化学兴趣小组设计了如下两种方案图。
方案Ⅰ
方案Ⅱ
①方案Ⅰ中,AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为:
。若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量分别为: mol、 mol。
②从消耗酸碱的用量角度考虑,方案 (填“Ⅰ”或“Ⅱ”)所消耗的酸碱少些。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)工业上SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
提示:①已知在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式.
②已知Ksp[Sn(OH)2] =1.0×10-26
回答下列问题:
(1)SnCl2用盐酸而不用水直接溶解的原因是__________,加入Sn粉的作用是_________。
(2)反应I生成的沉淀为SnO,写出该反应的离子方程式___________________________。
(3)检验沉淀已经“漂洗”干净的方法__________________________________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol?L-1,则应控制溶液pH_____。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,请写出发生反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
(1)提高“反应l”反应速率的措施有______________(写出一条即可)。
(2)“反应2”的氧化剂是________,该反应的化学方程式为__________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是__________________。
(4)从 “母液”中可回收的主要物质是__________________________。
(5)“冷却结晶”后经_____________(填操作名称)即可获得粗产品。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为: 。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:
①AB段: ;
②BC段 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
军用光敏材料KxFe(C2O4)y·3H2O(Fe为+3价)的实验室制备和测定其组成的方法如下所示:
Ⅰ.制备:
(1)用K2C2O4和FeCl3制备光敏材料的反应属于________(填序号)。
①离子反应 ②非氧化还原反应 ③氧化还原反应 ④化合反应
(2)结晶时应将饱和溶液放在黑暗处等待晶体的析出,这样操作的原因是_________。
(3)操作4的实验操作有____________。
Ⅱ.组成测定:
称取一定质量实验所得的晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4,将C2O42-完全转化为H2C2O4,用0.10 mol·L-1 KMnO4溶液进行滴定,消耗KMnO4溶液24.00 mL时恰好完全反应(酸性条件下MnO4-的还原产物是Mn2+);再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00 mL。
(4)高锰酸钾氧化H2C2O4和Fe2+的离子方程式分别是___________; ________。
(5)配制100 mL 0.10 mol·L-1 KMnO4溶液及在上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外,还有________和________(写名称)。
(6)通过计算,该化合物的化学式是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com